
Alotropii de carbon carbon amorf, grafit, grafeni, nanotuburi

alotropi de carbon sunt diferitele forme fizice în care atomii lor pot fi aranjați și legați. Fiecare corespunde unui solid cu propriile sale caracteristici speciale. Din punct de vedere molecular și structural, ei se disting unul de celălalt. Există două tipuri principale ale acestor alotropi: cristalină și amorfă..
Alotropii cristalini sunt cei care au un model care se repetă al atomilor lor în spațiu. Între timp, în alotropii amori, atomii sunt dispuși dezordonat, fără a exista două regiuni identice în solid. Deci, primele sunt ordonate, iar al doilea, dezordonate.
(https://creativecommons.org/licenses/by-sa/4.0)]
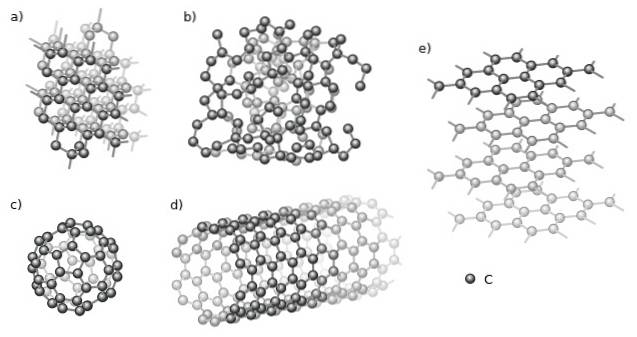
Printre cele cristaline se numără diamantul (a) și grafitul (e) prin excelență. Se observă în imaginea superioară diferite structuri care au un aspect comun: sunt compuse doar din atomi de carbon (sfere negre).
Și printre alotropii amori, avem carbonul amorf (b), care, după cum se poate vedea, structura sa este dezordonată. Cu toate acestea, există multe tipuri de carboni amorfi, deci este o familie de solide..
De asemenea, atomii de carbon pot forma supramolecule, cum ar fi fulerenele (c) și nanotuburile (d). Aceste supramolecule pot varia în mărime și formă, dar păstrează aceleași geometrii; sferice și tubulare pentru fulereni și, respectiv, nanotuburi.
Indice articol
- 1 Legături covalente de carbon
- 1.1 Hexagone
- 1.2 Tetraedre
- 2 Carbon amorf
- 2.1 Politicism
- 2.2 Grupuri funcționale
- 3 Grafit
- 3.1 Proprietăți fizice
- 4 grafene
- 5 nanotuburi de carbon
- 5.1 Conformații structurale
- 6 fulereni
- 7 Referințe
Legături covalente de carbon
Înainte de a aborda unii dintre alotropii cunoscuți ai carbonului, este necesar să se revizuiască modul în care se leagă atomii de carbon..
Conform teoriei legăturilor de valență, carbonul are patru electroni în învelișul său de valență, cu care formează legături covalente. Datorită promovării electronice și hibridizării, cei patru electroni pot fi așezați în patru orbitați separați, fie ei puri sau hibrizi.
Prin urmare, carbonul are capacitatea de a forma până la maximum patru legături.
DC. Având patru legături C-C, atomii ajung la octetul de valență și devin foarte stabili. Cu toate acestea, acest lucru nu înseamnă că nu pot exista doar trei dintre aceste legături, cum ar fi cele văzute în hexagoane..
Hexagone
În funcție de hibridizarea atomului de carbon, legăturile duble sau triple pot fi găsite în structura alotropilor lor. Dar, chiar mai evidentă decât existența unor astfel de legături, este geometria pe care o adoptă carbonii.
De exemplu, dacă se observă un hexagon, înseamnă că carbonii au hibridizare spDouă și, prin urmare, au un orbital p pur cu un electron singuratic. Puteți vedea hexagoane perfecte în prima imagine? Acele alotrope care le conțin implică faptul că carbonii lor sunt spDouă, dacă există sau nu legături duble (cum ar fi cele ale inelului benzenic).
Un strat de plasă, plan sau hexagonal este format din carboni spDouă care are un „plafon” sau „nor” electronic, produs al electronului nepereche al orbitalului p. Acest electron poate forma legături covalente cu alte molecule sau poate atrage sarcinile pozitive ale ionilor metalici; ca K+ și Na+.
La fel, acești electroni permit acestor cochilii să se adune unul peste altul, fără a se lega (datorită unui impediment geometric și spațial la suprapunerea celor doi orbitali p). Aceasta înseamnă că alotropii cu geometrii hexagonale pot sau nu să fie ordonați să construiască un cristal..
Tetrahedra
Dacă se observă un tetraedru, așa cum se va explica în ultima secțiune, înseamnă că carbonii au hibridizare sp3. În ele există patru legături C-C unice și formează o rețea cristalină tetraedrică. În astfel de tetraedre nu există electroni liberi ca în hexagoni..
Carbon amorf

Carbonul amorf poate fi imaginat ca un fel de burete poros, cu o mulțime de rețele hexagonale și tetraedrice dispuse în mod arbitrar. În această matrice minerală pot prinde alte elemente, care pot compacta sau extinde buretele menționat; și în același mod, nucleele sale structurale pot fi mai mari sau mai mici.
Astfel, în funcție de procentul de carbon, sunt derivate diferite tipuri de atomi de carbon amorf; precum funingine, cărbune, antracit, negru de fum, turbă, cocs și cărbune activ.
La prima vedere, toate arată similar de la distanță (imagine de sus), cu gradații până la marginea nuanțelor negre, plictisitoare sau metalice și cenușii..
Nu toți carbonii amorfi au aceeași origine. Carbonul vegetal, așa cum indică și numele său, este produsul arderii maselor vegetale și a lemnului. În timp ce negrul de fum și cocsul sunt produse din diferite etape și condiții ale proceselor petroliere..
Deși nu par foarte atractive și se poate crede că servesc doar ca combustibili, porozitățile solidelor lor atrag atenția în aplicațiile tehnologice de purificare, cum ar fi stocarea absorbanților și a substanțelor, precum și ca suport catalitic..
Politypism
Structurile carbonilor amorfi sunt complexe și dezordonate; dar, studiile cristalografice au arătat că, în realitate, acestea sunt polietipuri tetraedrice (diamant) și hexagonale (grafit), dispuse arbitrar în straturi.
De exemplu, dacă T și H sunt straturile tetraedrice și respectiv hexagonale, atunci un carbon amorf poate fi descris structural ca: THTHHTH; sau HTHTTHTHHHT etc. Anumite secvențe de straturi T și H definesc un tip de carbon amorf; dar în interiorul lor, nu există o tendință sau un model repetitiv.
Din acest motiv este structural dificil să se caracterizeze acești alotropi de carbon; și, în loc de asta, este preferat procentul său de carbon, care este o variabilă care îi facilitează diferențele, pe lângă proprietățile sale fizice și tendința de a arde.
Grup functional
S-a menționat că planurile hexagonale au un electron nepereche cu care poate forma o legătură cu alte molecule sau atomi. Dacă, să spunem, moleculele din jur sunt HDouăO și CODouă, Se poate aștepta să se formeze grupuri OH și COOH. De asemenea, se pot lega de atomii de hidrogen, formând legături C-H..
Posibilitățile sunt foarte variate, dar pe scurt carbonii amorf pot găzdui grupe funcționale oxigenate. Când acești heteroatomi sunt prezenți, nu sunt localizați doar pe marginile avioanelor, ci și chiar și în interior.
Grafit

Imaginea de mai sus prezintă un model cu sfere și șiruri ale structurii cristaline a grafitului. Din fericire, umbrele sferelor ajută la vizualizarea norilor π ca urmare a delocalizării electronilor lor nepereche. Acest lucru a fost menționat în prima secțiune, fără atâtea detalii.
Acești nori π pot fi comparați cu două sisteme: cel al inelelor benzenice și cel al „mării electronice” din cristalele metalice..
Orbitali p se unesc reciproc pentru a construi o pistă în care electronii călătoresc liber; dar, numai între două straturi hexagonale; perpendicular pe ele, nu există flux de electroni sau curent (electronii ar trebui să treacă prin atomii de carbon).
Deoarece există o migrație constantă a electronilor, se formează în mod constant dipoli instantanei, care induc alți dipoli de atomi de carbon care sunt deasupra sau dedesubt; adică straturile sau foile de grafit rămân împreună datorită forțelor de dispersie din Londra..
Aceste straturi hexagonale, după cum se poate aștepta, creează un cristal de grafit hexagonal; sau mai bine zis, o serie de cristale mici conectate la unghiuri diferite. Norii π se comportă ca și cum ar fi un „unt electric”, permițând straturilor să alunece înainte de orice perturbare externă a cristalelor.
Proprietăți fizice
Proprietățile fizice ale grafitului sunt ușor de înțeles odată ce structura sa moleculară a fost abordată..
De exemplu, punctul de topire al grafitului este foarte mare (peste 4400 ° C), deoarece energia furnizată sub formă de căldură trebuie să separe ireversibil straturile hexagonale și, de asemenea, să le rupă hexagonele..
S-a spus doar că straturile lor pot aluneca una peste alta; Și nu numai, dar pot ajunge și deasupra altor suprafețe, cum ar fi celuloza care alcătuiește hârtia atunci când este depusă din grafitul creioanelor. Această proprietate permite grafitului să acționeze ca un lubrifiant excelent..
Și, menționat deja, este un bun conductor al electricității, precum și al căldurii și sunetului..
Grafene

Deși nu a fost prezentat în prima imagine, acest alotrop de carbon nu poate fi lăsat deoparte. Să presupunem că straturile de grafit au fost prinse și condensate într-o singură foaie, deschise și acoperind o suprafață mare. Dacă acest lucru s-ar face molecular, s-ar naște grafeni (imaginea superioară).
Deci, graphenes este o foaie grafitică individuală, care nu interacționează cu alții și poate flutura ca un steag. Rețineți că are o asemănare cu pereții fagurilor de albine.
Aceste foi de grafen păstrează și înmulțesc proprietățile grafitului. Hexagonele sale sunt foarte greu de separat, motiv pentru care prezintă o rezistență mecanică abisală; chiar mai sus decât oțelul. În plus, sunt extrem de ușoare și subțiri și teoretic un gram dintre ele ar fi suficient pentru a acoperi un întreg teren de fotbal..
Dacă vă uitați din nou la imaginea de sus, puteți vedea că nu există legături duble. Cu siguranță, pot exista și ele, precum și triple legături (graffins). Aici se deschide chimia grafenului, să zicem.
La fel ca grafitul și celelalte straturi hexagonale, alte molecule se pot lega covalent de suprafața grafenului, funcționalizând structura acestuia pentru aplicații electronice și biologice..
Nanotuburi de carbon
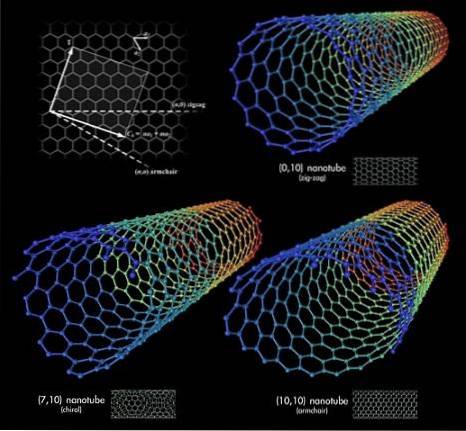
Acum, să presupunem că am apucat foile de grafen și am început să le rostogolim într-un tub; Acestea sunt nanotuburile de carbon. Lungimile și raza acestor tuburi sunt variabile, precum și conformațiile lor spațiale. Împreună cu grafenul și fullerenele, aceste nanotuburi alcătuiesc triada celor mai surprinzătoare alotrope de carbon.
Conformații structurale
Trei nanotuburi de carbon sunt prezentate în imaginea superioară. Care este diferența dintre ele? Toate cele trei au pereți cu model hexagonal și prezintă aceleași proprietăți de suprafață deja discutate. Răspunsul se află atunci în orientările relative ale acestor hexagone.
Prima conformație corespunde tipului de zigzag (colțul din dreapta sus). Dacă priviți cu atenție, veți vedea că are rânduri de hexagoane poziționate perfect perpendicular pe axa longitudinală a tubului..
În schimb, pentru conformația de tip fotoliu, sau scaun (colțul din dreapta jos), hexagonele sunt dispuse în rânduri în aceeași direcție ca axa longitudinală a tubului. În primul nanotub, hexagoanele traversează suprafața în sensul diametrului său, iar în al doilea nanotub, acestea rulează de-a lungul suprafeței, de la „capăt la cap”.
Și, în cele din urmă, există nanotubul chiral (colțul din stânga jos). Compară o scară în spirală care merge la stânga sau la dreapta. Același lucru se întâmplă cu acest nanotub de carbon: hexagonele sale sunt dispuse ascendent spre stânga sau dreapta. Deoarece există două versiuni spațiale, se spune atunci că prezintă chiralitate.
Fullereni
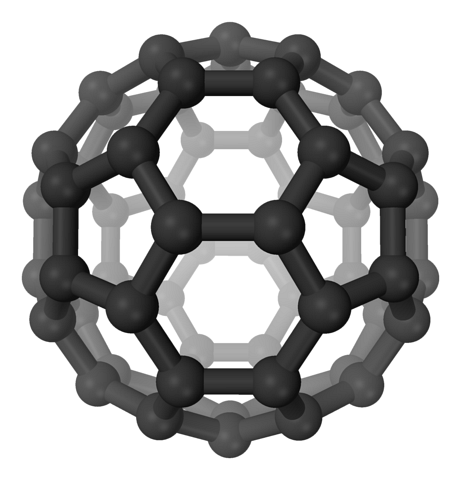
În fullereni, hexagonele sunt încă menținute, dar în plus, apar și pentagonele, toate cu carboni spDouă. Cearșafurile sau straturile sunt deja lăsate în urmă: acum au fost pliate în așa fel încât formează o minge, asemănătoare cu o minge de fotbal; și în funcție de numărul de carboni, la o minge de rugby.
Fulerenele sunt molecule care diferă ca mărime. Cel mai faimos este C60 (imaginea de sus). Acești alotropi de carbon ar trebui tratați ca baloane, care se pot strânge împreună pentru a forma cristale, în care ioni și alte molecule pot fi prinși în interstițiile lor..
Aceste bile sunt purtători speciali sau suporturi pentru molecule. Cum? Prin legăturile covalente la suprafața sa, în special, la carbonii adiacenți ai unui hexagon. Se spune apoi că fulerena a fost funcționalizată (un aduct exohedric).
Pereții săi pot fi rupți strategic pentru a stoca molecule în interior; asemănătoare unei capsule sferice. De asemenea, aceste bile pot avea fisuri și pot fi funcționalizate în același timp; totul va depinde de aplicația căreia îi sunt destinate.
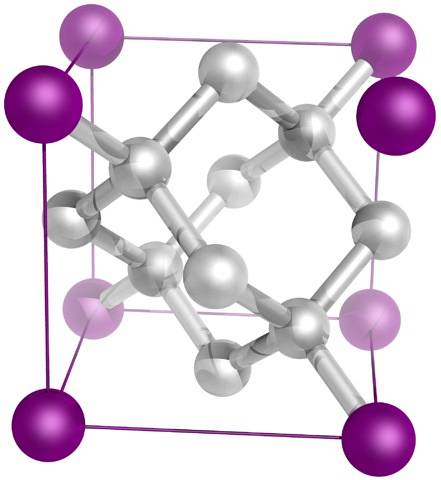
Și, în cele din urmă, cel mai cunoscut dintre toți alotropii carbonului: diamantul (deși nu toți sunt carbon).
Structural este format din atomi de carbon sp3, formând patru legături C-C și o rețea tridimensională de tetraedre (imagine superioară) a căror celulă cristalină este cubică. Este cel mai greu mineral, iar punctul său de topire este aproape de 4000 ° C..
Tetraedrele sale sunt capabile să transfere căldura în mod eficient în rețeaua de cristal; dar nu cu electricitatea, deoarece electronii săi sunt foarte bine localizați în cele patru legături covalente și nu pot merge nicăieri. Prin urmare, este un bun conductor termic, dar este un izolator electric..
În funcție de modul în care este fațetată, poate împrăștia lumina în multe unghiuri luminoase și atractive, motiv pentru care sunt râvnite ca pietre prețioase și bijuterii..
Rețeaua este foarte rezistentă, deoarece ar avea nevoie de multă presiune pentru a-și deplasa tetraedrul. Această proprietate îl face un material cu rezistență mecanică ridicată și duritate, capabil să facă tăieturi precise și curate, ca și în cazul bisturiului cu vârf de diamant..
Culorile lor depind de defectele cristalografice și de impuritățile lor.
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Méndez Medrano, Ma. Guadalupe, Rosu, H. C., Torres González, L. A. (2012). Grafen: cel mai promițător alotrop de carbon. Actul universitar. vol. 22, nr. 3, aprilie-mai, 2012, pp. 20-23, Universitatea din Guanajuato, Guanajuato, Mexic.
- IES La Magdalena. Aviles. Asturia. (s.f.). Forme alotrope de carbon. [PDF]. Recuperat de pe: fisquiweb.es
- Wikipedia. (2019). Alotropii de carbon. Recuperat de pe: es.wikipedia.org
- Sederberg David. (s.f.). Alotropii de carbon. Recuperat de pe: web.ics.purdue.edu
- Sederberg, D. (2009). Alotropi de carbon: totul este în felul în care sunteți împreună. Recuperat din: physics.purdue.edu
- Hirsh A. (2010). Era alotropilor de carbon. Departamentul de Chimie și Farmacie și Centrul Interdisciplinar al Materialelor Moleculare (ICMM), Universitatea Friedrich-Alexander Erlangen-Nürnberg, Henkestrasse 42, 91054 Erlangen, Germania.
- Consiliul Regenților al Universității din Wisconsin System. (2013). Nanotuburi și alte forme de carbon. Recuperat de la: chemistry.beloit.edu
- Clark Jim. (2012). Structuri covalente gigantice. Recuperat de pe: chemguide.co.uk



Nimeni nu a comentat acest articol încă.