
Formarea, caracteristicile și tipurile de anioni
A anion Este orice specie chimică cu sarcină negativă, pe lângă faptul că este unul dintre cele două tipuri de ioni existenți. Sarcina sa negativă provine din faptul că are un exces de electroni în comparație cu forma neutră a speciei; pentru fiecare electron suplimentar, sarcina sa negativă crește cu o unitate.
Sarcina negativă poate fi localizată într-unul sau mai mulți atomi, precum și poate include influența acesteia asupra unei molecule ca întreg. Pentru simplitate, indiferent de locul în care se află sarcina (-), întreaga specie, compus sau moleculă este considerată un anion..
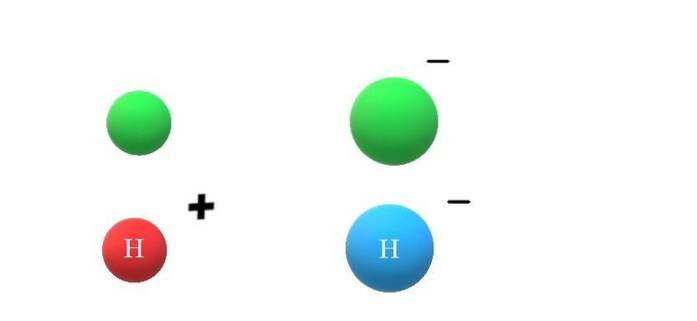
Dacă o specie neutră X câștigă un electron, excesul de sarcini negative se va manifesta prin formarea anionului X-, ceea ce va duce și la creșterea razei sale atomice (imaginea superioară, cu sfere verzi). X și X- diferă enorm prin proprietățile lor și prin modul în care interacționează cu mediul lor.
Dacă acum se presupune că X este atomul H, de exemplu, un cation sau anion poate apărea din acesta: H+ sau H-, respectiv. Cationul H+ Este ionul hidrogen, numit și proton; iar H- este anionul hidrură, "cel mai simplu" dintre toți anionii cunoscuți.
Indice articol
- 1 Formarea unui anion
- 1.1 Taxe formale și mai puține legături
- 1.2 Reduceri
- 1.3 Fizica
- 2 caracteristici
- 3 tipuri
- 3.1 Monatomic
- 3.2 Oxoanioni
- 3.3 Organic
- 3.4 Polyatomic
- 3.5 Moleculare sau complexe
- 4 Referințe
Formarea unui anion
Formarea unui anion poate fi ușor explicată în cadrul teoriei; Deși, experimental, poate fi o provocare, mai ales dacă o doriți pură, fără sarcini pozitive atrase de sarcinile sale negative..
Taxe formale și mai puține linkuri
Un anion se va forma atunci când există un exces sau un câștig de electroni într-un atom. Câștigul menționat poate fi determinat prin utilizarea taxelor formale într-o structură Lewis. De asemenea, folosind metoda anterioară puteți ști exact din ce atom sau grup din aceștia provine sarcina negativă.
Când atomii formează legături covalente, chiar dacă distribuția electronilor este echitabilă, poate exista o pierdere parțială a electronilor. În acest sens, cu cât sunt mai puține legături cu atât se formează mai mulți atomi electronegativi, cu atât vor avea mai multe perechi libere de electroni și, prin urmare, prezintă sarcini negative..
Luați în considerare, de exemplu, molecula de amoniac, NH3. NH3 este neutru și, prin urmare, nu are încărcări electrice. Dacă s-ar elimina un H, adică s-ar rupe o legătură N-H, s-ar obține anionul NHDouă-. Desenând structura lui Lewis și calculând sarcina formală a lui N, acest lucru poate fi verificat.
După ruperea mai multor legături N-H, avem acum anionul NHDouă-; și eliminând ultimul H, se obține în cele din urmă anionul N3-, numit anion nitrid. Azotul nu mai are o modalitate de a câștiga mai mulți electroni, iar sarcina -3 este cea mai negativă pe care o poate atinge; orbitalii lor nu dau pentru mai mult.
Reduceri
Un anion se poate forma ca urmare a unei reduceri: câștigă electroni prin oxidarea unei alte specii, care îi pierde. Oxigenul, de exemplu, reprezintă foarte bine acest tip de reacție chimică..
Când oxigenul este redus, acesta se oxidează la o altă specie și devine anionul oxid, ODouă-; prezent în nenumărate minerale și compuși anorganici.
Fizic
Un atom poate câștiga electroni dacă se află în faza gazoasă:
X (g) + e- => X-(g)
Acest mod de a forma un anion implică o cunoaștere largă a tehnicilor fizice, în timp ce anionii gazoși nu sunt ușor de studiat și nici toate speciile nu sunt ușor volatilizate sau atomizate în faza gazoasă..
Caracteristici
În termeni generali, caracteristicile tipice ale unui anion vor fi menționate mai jos înainte de a discuta tipurile și exemplele lor:
-Este mai voluminoasă decât atomul neutru din care este derivat.
-Poate fi mai mult sau mai puțin stabil, în ciuda repulsiei electronice în creștere între electronii săi.
-Dacă anionul provine dintr-un atom cu nivel scăzut electronegativ, cum ar fi carbonul, acesta este foarte reactiv.
-Stabiliți momente dipolare puternice.
-Crește și mai mult interacțiunea sa cu solvenții polari.
-Anionul monatomic este izoelectronic cu gazul nobil din perioada sa; adică are același număr de electroni în învelișul său de valență.
-Poate polariza norul de electroni al unui atom vecin, respingând electronii săi externi.
Tipuri
Monatomic
După cum sugerează și numele său, este un anion care constă dintr-un singur atom: sarcina negativă este bine localizată. Fiecare grup din tabelul periodic are sarcini negative caracteristice; și pentru că sunt anioni, sunt nemetalele situate în blocul p. Câteva exemple și numele lor sunt mai jos:
-Cl-, clorură.
-Eu-, Durez.
-F-, fluor.
-Fr-, bromură.
-SAUDouă-, oxid.
-SDouă-, sulfură.
-stiuDouă-, selenidă.
-CeaiDouă-, telurid.
-PoDouă-, poloniur.
-N3-, azotură.
-P3-, fosfură.
-As3-, arsenid.
-Sb3-, antimoniuro.
-C4-, carbura.
-da4-, silicida.
-B3-, boruro.
Oxoanioni
Oxoanionii se caracterizează prin faptul că au o legătură X = O, unde X poate fi orice element nemetalic (cu excepția fluorului) sau un metal (crom, mangan, etc.). De asemenea, pot avea unul sau mai multe link-uri X-O simple.
Unii oxoanioni cu numele lor respective sunt:
-ClO-, hipoclorit.
-BrO-, hipobromit.
-IO-, hipoiodit.
-ClODouă-, clorit.
-ClO3-, clorat.
-IO3-, iodat.
-ClO4-, perclorat.
-PO43-, fosfat.
-CO3Două-, carbonat.
-CrO4Două-, cromat.
-CrDouăSAU7Două-, dicromat.
-SW4Două-, sulfat.
-SDouăSAU3Două-, tiosulfat.
-NU3-, nitrat.
-NUDouă-, nitrit.
-BO33-, borat.
-AsO43-, arseniat.
-PO33-, fosfit.
-MnO4-, permanganat.
Organic
Moleculele organice au grupuri funcționale care pot deveni încărcate electric. Cum? Prin formarea sau ruperea legăturilor covalente, foarte asemănător cu exemplul moleculei de NH3.
Unii anioni organici sunt:
-CH3GÂNGURI-, acetat.
-HCOO-, Format.
-CDouăSAU4Două-, oxalat.
-RCOO-, carboxilat.
-CH3CONH-, amidate.
-RO-, alcoxid.
-R3C-, carbanion.
-CH3SAU-, metoxid.
Polyatomic
Oxoanionii sunt, de asemenea, anioni poliatomici, adică constau din mai mult de un atom. La fel se întâmplă și cu anionii organici. Cu toate acestea, poliatomica nu se încadrează în niciuna dintre clasificările de mai sus. Unii dintre ei sunt:
-CN-, cianură (are o legătură triplă, C≡N).
-OCN-, cianat.
-SCN-, tiocianat.
-NHDouă-, Amidă.
-Oh-, hidroxil, hidroxid sau hidroxil.
-SAUDouă-, superoxid.
-SAUDouăDouă-, peroxid.
Moleculare sau complexe
La anioni organici au fost menționate unele grupuri funcționale încărcate negativ. Aceste grupuri pot face parte dintr-o moleculă mare și, astfel, anionul poate fi un compus întreg robust, cu multe legături. Cel mai simplu dintre acest tip de anioni este molecula ipotetică de HDouă-.
Un alt exemplu al acestor anioni sunt polisulfurile, SnDouă-, care constau din lanțuri cu legături S-S multiple. De asemenea, compuși de coordonare a metalelor încărcați negativ, cum ar fi [CoCl4(NH3)Două]- și [CuCl4]Două-.
Referințe
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Wikipedia. (2019). Anion. Recuperat de pe: es.wikipedia.org
- Helmenstine, Anne Marie, dr. (21 martie 2019). Tabelul anionilor obișnuiți și lista formulelor. Recuperat de pe: thoughtco.com
- Fundația CK-12. (2016, 29 iunie). Formarea anionilor. Chimie LibreTexte. Recuperat de pe: chem.libretexts.org
- Francis E. (2002). Anioni. Clackamas Community College. Recuperat de la: dl.clackamas.edu
- Societatea fizică americană. (3 noiembrie 2011). Sinopsis: Cel mai simplu anion molecular. Recuperat de pe: physics.aps.org



Nimeni nu a comentat acest articol încă.