
Istoria, structura, proprietățile, utilizările și riscurile antimoniului
antimoniu Este un metaloid lucios, argintiu, cu o anumită nuanță albăstruie. Solidul său este, de asemenea, caracterizat prin faptul că este foarte fragil și are o textură fulgi. Aparține grupului 15 al tabelului periodic, condus de azot. După bismut (și moscoviu), este cel mai greu element al grupului.
Este reprezentat de simbolul chimic Sb. În natură se găsește în principal în minereuri minerale stibite și ullmannite, ale căror formule chimice sunt SbDouăS3 și respectiv NiSbS. Tendința sa ridicată de a forma sulfuri în loc de oxizi se datorează faptului că este moale din punct de vedere chimic.

Pe de altă parte, antimoniul este, de asemenea, moale din punct de vedere fizic, prezentând o duritate de 3 pe scara Mohs. Este stabil la temperatura camerei și nu reacționează cu oxigenul din aer. Dar atunci când este încălzit în prezența oxigenului, formează trioxid de antimoniu, SbDouăSAU3.
La fel, este rezistent la acțiunea acizilor slabi; dar când este fierbinte este atacat de acizi nitric și clorhidric.
Antimoniul are numeroase aplicații, printre care este utilizat în aliaje cu plumb și staniu, la fabricarea bateriilor vehiculelor, a materialelor cu frecare redusă etc..
Acest metaloid are proprietatea rară de a crește volumul atunci când se solidifică, permițând aliajelor sale să ocupe pe deplin spațiul folosit pentru modelarea instrumentului care urmează să fie fabricat..
Indice articol
- 1 Istoria descoperirii sale
- 1.1 Înaintea lui Hristos
- 1.2 Introducerea termenului
- 1.3 Obținerea
- 2 Structura antimoniului
- 2.1 Alotropia
- 3 Proprietăți
- 3.1 Greutatea atomică
- 3.2 număr atomic
- 3.3 Configurare electronică
- 3.4 stări de oxidare
- 3.5 Descrierea fizică
- 3.6 Punct de topire
- 3.7 Punct de fierbere
- 3.8 Densitate
- 3.9 Căldura de fuziune
- 3.10 Căldura de vaporizare
- 3.11 Capacitatea de căldură molară
- 3.12 Electronegativitate
- 3.13 Raza atomică
- 3.14 Duritate
- 3.15 Stabilitate
- 3.16 Izotopi
- 3.17 Conductivitatea electrică și termică
- 3.18 Reactivitate chimică
- 4 utilizări
- 4.1 Aliaje
- 4.2 ignifug
- 4.3 Domeniul electronic
- 4.4 Medicină și veterinar
- 4.5 Pigmenți și vopsele
- 4.6 Alte utilizări
- 5 Riscuri
- 6 Referințe
Istoria descoperirii sale
Î.Hr.
Există dovezi că din 3100 î.Hr., sulfura de antimoniu a fost folosită ca produs cosmetic în Egipt. În Mesopotamia, Irakul actual, s-au găsit rămășițe ale unei vaze și a unui alt artefact care, probabil, datează între 3000 și 2200 î.Hr., în care antimonul a fost folosit în elaborarea sa.
Introducerea termenului
Savantul roman Pliniu cel Bătrân (23-79 d.Hr.) a descris folosirea antimoniului, pe care l-a numit stibiu, în elaborarea a șapte medicamente în Tratatul său de istorie naturală. Alchimistului Abu Mussa Jahir Ibn Hayyan (721-815) i se atribuie introducerea termenului antimoniu pentru a denumi elementul.
El a folosit următoarea etimologie: „anti” ca sinonim pentru negație și „mono” doar pentru. Apoi a vrut să sublinieze că antimoniul nu se găsea numai în natură. Se știe deja că face parte din mineralele sulfuroase, precum și din multe alte elemente.
Obținerea
Se crede că naturistul grec Pedanius Diascorides a obținut antimoniu pur, prin încălzirea sulfurii de antimoniu într-un curent de aer. Metalurgistul italian Vannocio Biringucio, în cartea De la Pirotecnia (1540), face o descriere a unei metode de izolare a antimoniului.
Chimistul german Andreas Libavius (1615), folosind un amestec topit de fier, sulfură de antimoniu, sare și tartrat de potasiu, a realizat producerea unui antimoniu cristalin.
Primul raport detaliat despre antimoniu a fost făcut în 1707 de chimistul francez Nicolas Lemery (1645-1715), în cartea sa Tratat de antimoniu.
Structura antimoniului
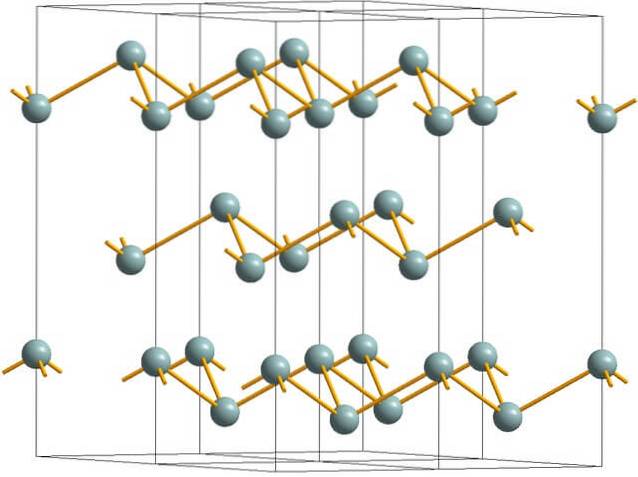
Imaginea superioară prezintă structura stratificată încrețită adoptată de atomii de arsen. Totuși, antimoniul cenușiu, mai bine cunoscut sub numele de antimoniu metalic, adoptă și această structură. Se spune că este „încrețit” deoarece există atomi de Sb care se ridică și cad din planul compus din strat.
Aceste straturi, deși sunt responsabile pentru fotonii care interacționează cu acesta, strălucesc străluciri argintii, făcând ca antimoniul să treacă ca un metal, adevărul este că forțele care le unesc sunt slabe; prin urmare, fragmentele de metal aparente ale Sb pot fi ușor măcinate și fragile sau fulgi.
De asemenea, atomii de Sb din straturile încrețite nu sunt suficient de apropiați pentru a-și grupa orbitalii atomici pentru a crea o bandă care permite conducerea electrică..
Privind individual o sferă cenușie, se poate vedea că are trei legături Sb-Sb. Dintr-un plan superior, Sb putea fi văzut în centrul unui triunghi, cu trei Sb situate la vârfurile sale. Cu toate acestea, triunghiul nu este plat și are două niveluri sau etaje..
Reproducerea laterală a acestor triunghiuri și legăturile lor stabilesc straturi încrețite, care se aliniază pentru a forma cristale romboedrice..
Alotropie
Structura tocmai descrisă corespunde antimoniului cenușiu, cel mai stabil dintre cei patru alotropi ai săi. Celelalte trei alotropi (negru, galben și exploziv) sunt metastabile; adică pot exista în condiții foarte dure.
Nu există prea multe informații referitoare la structurile lor. Se știe, totuși, că antimoniul negru este amorf, deci structura sa este dezordonată și complicată..
Antimoniul galben este stabil sub -90 ° C, se comportă ca un element nemetalic și poate fi presupus că este format din mici aglomerate de tip Sb4 (similare cu cele ale fosforului); când este încălzit, se transformă în alotrop negru.
Și în ceea ce privește antimoniul exploziv, acesta constă dintr-un depozit gelatinos format pe catod în timpul electrolizei unei soluții apoase de halogenură de antimoniu..
La cea mai mică frecare sau impact puternic, solidul moale eliberează atât de multă căldură încât explodează și se stabilizează pe măsură ce atomii săi se regrupează în structura cristalină romboedrică a antimoniului cenușiu..
Proprietăți
Greutate atomica
121,76 g / mol.
Numar atomic
51.
Configurare electronică
[Kr] 4d105sDouă5 p3.
Stări de oxidare
-3, -2, -1, +1, +2, +3, +4, +5.
Descriere Fizica
Solid argintiu lucios, fragil, cu o suprafață solzoasă, cu o nuanță albăstruie. Poate apărea și sub formă de pulbere neagră.
Punct de topire
630,63 ºC.
Punct de fierbere
1.635 ºC.
Densitate
-6,697 g / cm3 la temperatura camerei.
-6,53 g / cm3 în stare lichidă, temperatura egală sau mai mare decât punctul de topire.
Căldura de fuziune
19,79 kJ / mol.
Căldura de vaporizare
193,43 kJ / mol.
Capacitatea de căldură molară
25,23 J / mol.K
Electronegativitate
2.05 (scara Pauling).
Radio atomic
Ora 140.
Duritate
Este un element moale, cu o duritate de 3 pe scara Mohs și poate fi zgâriat de sticlă.
Stabilitate
Este stabil la temperatura camerei, fără a experimenta oxidare. De asemenea, este rezistent la atacul acid.
Izotopi
Are doi izotopi stabili: 121Sb și 123Sb. În plus, există 35 de izotopi radioactivi. Izotopul radioactiv 125Sb este cel cu cel mai lung timp de înjumătățire: 2,75 ani. În general, izotopii radioactivi emit radiații β+ și β-.
Conductivitate electrică și termică
Antimoniul este un conductor slab de căldură și electricitate.
Reactivitatea chimică
Nu poate deplasa hidrogenul din acizii diluați. Formează complexe ionice cu acizi organici și anorganici. Antimoniul metalic nu reacționează cu aerul, ci se transformă rapid în oxid în aerul umed..
Halogenii și sulfurile oxidează ușor antimoniul, dacă procesul are loc la temperaturi ridicate.
Aplicații
Aliaje
Antimoniul este utilizat într-un aliaj cu plumb pentru a face plăci pentru bateriile auto, îmbunătățind rezistența plăcilor, precum și caracteristicile încărcărilor..
Aliajul cu plumb și staniu a fost utilizat pentru îmbunătățirea caracteristicilor sudurilor, precum și a gloanțelor de urmărire și a detonatoarelor de cartușe. Este, de asemenea, utilizat în aliaje pentru acoperirea cablurilor electrice..
Antimoniul este utilizat în aliajele antifricțiune, la fabricarea aliajelor de cositor și de întărire cu conținut redus de staniu la fabricarea organelor și a altor instrumente muzicale..
Are caracteristica, împărtășită cu apa, de a crește în volum atunci când se condensează; Prin urmare, antimoniul prezent în aliaje cu plumb și staniu, umple toate spațiile din matrițe, îmbunătățind definiția structurilor realizate cu aliajele menționate..
Ignifug
Trioxidul de antimoniu este utilizat pentru a produce compuși ignifugi, întotdeauna în combinație cu ignifugi halogenați, bromuri și cloruri..
Ignifugii pot reacționa cu atomii de oxigen și radicalii OH, ceea ce inhibă focul. Acești ignifugi sunt utilizați în îmbrăcămintea pentru copii, jucării, aeronave și în scaunele auto.
Acestea sunt, de asemenea, adăugate în rășini de poliester și în compozite din fibră de sticlă pentru articolele utilizate ca învelitoare pentru motoarele de aeronave ușoare..
Compușii antimoniului care sunt folosiți ca ignifugi includ: oxiclorură de antimoniu, SbOCl; pentoxid de antimoniu, SbO5; triclorură de antimoniu, SbCl3; și trioxid de antimoniu, SbO3.
Domeniul electronic
Este utilizat la fabricarea semiconductoarelor, diodelor, detectoarelor cu infraroșu mediu și la fabricarea tranzitorilor. Antimoniul de înaltă puritate, utilizat în tehnologia semiconductoarelor, se obține prin reducerea compușilor antimoniului cu hidrogen.
Medicină și veterinar
Compușii de antimoniu au fost folosiți în medicină încă din cele mai vechi timpuri ca emetici și antiprotozoare. Tartratul de potasiu potasic (tartric emetic) a fost folosit ca antischistozom mult timp; fiind folosit, în plus, ca expectorant, diaforetic și emetic.
Sărurile de antimoniu au fost folosite și în condiționarea pielii animalelor rumegătoare; cum ar fi aniomalina și tiomalatul de antimoniu de litiu.
Antimoniacul de meglumină este un medicament utilizat în tratamentul leishmaniozei în focarele externe ale animalelor domestice. Deși, beneficiile terapeutice au fost limitate.
Pigmenți și vopsele
Compușii de antimoniu sunt utilizați la fabricarea vopselelor și a opacifiantului în emailuri. Sunt utilizați și în pigmenți roșii, galbeni și portocalii, care sunt produse de oxidarea lentă a sulfurilor de antimoniu..
Unele dintre sărurile sale organice (tartrați) sunt utilizate în industria textilă pentru a ajuta la legarea anumitor coloranți.
Sulfura de antimoniu a fost folosită în Egiptul antic ca produs cosmetic pentru întunecarea ochilor.
Alte utilizări
Unele săruri de antimoniu sunt utilizate ca agenți de acoperire pentru a îndepărta bulele microscopice care se formează pe ecranele televizorului. Ionii de antimoniu interacționează cu oxigenul, eliminând tendința acestuia de a forma bule.
Sulfura de antimoniu (III) este utilizată în capetele unor meciuri de siguranță. Sulfura de antimoniu este, de asemenea, utilizată pentru stabilizarea coeficientului de frecare a materialelor utilizate în plăcuțele de frână auto..
Izotop 124Sb, împreună cu beriliu, este utilizat ca sursă de neutroni, cu o medie energetică de 24 keV. În plus, antimoniul este utilizat ca catalizator în producția de materiale plastice..
Riscuri
Este un element fragil, astfel încât se poate produce un praf poluant din mediu în timpul manipulării acestuia. La lucrătorii expuși la praf de antimoniu, s-au observat dermatite, renite, inflamații ale căilor respiratorii superioare și conjunctivite.
Pneumoconioza, uneori combinată cu modificări pulmonare obstructive, a fost descrisă după expuneri prelungite.
Trioxidul de antimoniu poate provoca leziuni care pun viața în pericol funcției inimii.
La persoanele expuse acestui element s-a observat prezența infecțiilor cutanate pustulare tranzitorii..
Aportul continuu de doze mici de acest metal poate provoca diaree, vărsături și ulcere gastrice. De asemenea, concentrația maximă tolerabilă în aer este de 0,5 mg / m3.
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Multe. (11 martie 2009). Antimoniu galben și antimoniu exploziv. Recuperat de pe: antimonyproperties.blogspot.com
- Prof. Ernst Cohen și J. C. Van Den Bosch. (1914). Alotropia Antimoniului. Proceduri Royal Acad. Amsterdam. Vol. XVII.
- Wikipedia. (2019). Antimoniu. Recuperat de pe: en.wikipedia.org
- Advameg, Inc. (2019). Antimoniu. Recuperat de pe: chemistryexplained.com
- Sable Mc'Oneal. (15 septembrie 2018). Chimie: proprietăți și aplicare a Sb-Antimoniului. Recuperat de pe: medium.com


Nimeni nu a comentat acest articol încă.