
Structura borohidrurii de sodiu (NaBH4), proprietăți, utilizări

borohidrură de sodiu este un solid anorganic a cărui formulă chimică este NaBH4. Poate fi considerat reprezentativ pentru borohidrurile alcaline și este cel mai frecvent dintre acestea. Este un solid cristalin alb.
Când este în contact cu apa, NaBH4 poate genera căldură și hidrogen HDouă care este combustibil, deci trebuie manipulat cu precauție. Datorită ușurinței cu care poate genera ioni hidrură H-, borohidrura de sodiu este un compus moderat reducător, deci este utilizat pe scară largă în reacțiile chimice în acest scop.

Proprietatea sa de reducere este utilizată și în industria hârtiei, deoarece îmbunătățește caracteristicile de luminozitate și stabilitate ale pastei și hârtiei acționând împotriva oxidării celulozei, componenta principală a hârtiei..
Deoarece poate forma cu ușurință hidrogen în prezența apei, a fost de asemenea investigată posibilitatea utilizării acestuia ca sursă reversibilă de hidrogen în pilele de combustibil..
Are alte utilizări, toate bazate pe proprietatea sa reducătoare, cum ar fi în industria farmaceutică.
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți fizice
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Temperatura de autoinflamare
- 3.4 Temperatura de descompunere
- 3.5 Densitate
- 3.6 Solubilitate
- 4 Proprietăți chimice
- 5 Riscuri
- 6 Obținerea
- 7 utilizări
- 7.1 În reacții chimice de reducere
- 7.2 În producția de H2 în pilele de combustibil
- 7.3 În industria celulozei și hârtiei
- 7.4 În diverse utilizări
- 8 Referințe
Structura
Borohidrura de sodiu este un compus ionic. Este format din anionul borohidrida [BH4]- atașat la cationul de sodiu Na+.
Anionul [BH4]- este tetraedrică.
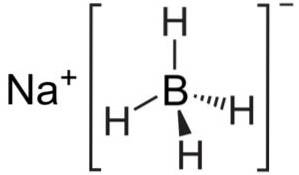
Structura sa Lewis este următoarea:
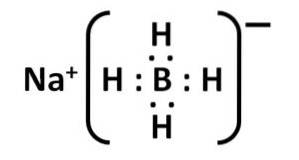
Nomenclatură
-Borohidrură de sodiu
-Tetrahidroborat de sodiu
-Tetrahidroborat de sodiu
Proprietăți fizice
Starea fizică
Cristal alb solid.
Greutate moleculară
37,84 g / mol
temperatură de autoaprindere
∼ 220 ºC
Temperatura de descompunere
> 250 ºC
Densitate
1,074 g / cm3 la 20 ° C
Solubilitate
NaBH4 este destul de solubil în apă (55 g / 100mL la 25 ° C), unde este parțial hidrolizat. Este solubil în tetrahidrofuran (THF) și este insolubil în dietil eter.
Proprietăți chimice
Borohidrura de sodiu se dizolvă în apă, unde suferă o descompunere inițială sau hidroliză care face ca soluția să fie de bază, prevenind hidroliza ulterioară..
[BH4]- + HDouăO → B (OH)3 + HDouă↑ + OH-
Acest lucru se explică deoarece [BH4]- interacționează cu H+ a apei, unde H+ ia un anion hidrură H- pentru a forma HDouă. Se poate spune că BH3 concurează cu H+ de ionul hidrură H-.
În mediu acid hidroliza este completă datorită abundenței ionilor H+.
NaBH4 este stabil în aer uscat. Nu este volatil.
Datorită conținutului său de ioni hidrură, borohidrura de sodiu este un compus reducător. Permite reducerea grupării carbonil C = O la C-OH, adică a compușilor carbonilici la alcooli.
NaBH4 În sine nu reduce legăturile duble C = C, nici măcar cele conjugate cu grupări carbonil -C = C-C (= O)-.
Cu toate acestea, atunci când este în contact cu acizi protonici (cum ar fi HCI) sau acizi Lewis (cum ar fi BCl3 sau AlCl3) se formează diboranul BDouăH6. Și dacă această reacție se efectuează în prezența compușilor organici cu legături duble C = C, diboran BDouăH6 efectuează hidroborarea acestora.
În prezența catalizatorilor și a condițiilor specifice, borohidrura de sodiu poate reduce diferite tipuri de grupe funcționale.
Riscuri
Căldura reacției de hidroliză în apă este suficientă pentru a aprinde hidrogenul care se formează în ea. Deci, este important să aveți grijă atunci când îl manipulați.
NaBH4 se aprinde ușor și arde ușor.
Obținerea
Reacția tipică de preparare a NaBH4 este prin hidrură de sodiu NaH și B (OCH3)3 la o temperatură de aproximativ 250 ºC:
4 NaH + B (OCH3)3 → NaBH4 + 3 NaOCH3
Aplicații
În reducerea reacțiilor chimice
Deoarece este o sursă de ioni H-, NaBH4 Este un compus reducător și este utilizat pentru a prepara alți compuși chimici. Pentru aceasta este utilizat în solvenți polari aprotici, adică fără protoni H+, cum ar fi dimetil sulfoxidul, hexametilfosforamida și dimetilformamida.
Este utilizat ca agent de reducere atât în reacțiile chimice organice, cât și în cele anorganice..
Permite reducerea aldehidelor în alcooli primari și cetonelor în alcooli secundari.
De asemenea, reduce halogenurile de alchil în hidrocarburi, cum ar fi iododecanul în decan, acidul bromoundecanoic în acidul undecanoic și clorododecanul în dodecanul..
Dacă acționează singur, la efectuarea reducerii nu afectează alte grupe funcționale precum ester, acid carboxilic, nitril și sulfonă.
Proprietatea sa de a nu reduce legăturile duble C = C, nici măcar cele conjugate cu grupări carbonil -C = C-C (= O) -, face posibilă prepararea alcoolilor nesaturați -C = C-CHDouă-Oh.
Pentru a reduce compușii aromatici nitrați la anilinele corespunzătoare necesită prezența unor catalizatori precum cobalt sau clorură de staniu. Reduce disulfurile la tioli.
În prezența condițiilor adecvate și a catalizatorilor, permite reducerea acizilor carboxilici, esterilor, amidelor, nitrililor, iminelor, epoxizilor și chiar a legăturilor duble și triple.
În producția de HDouă în pilele de combustibil
NaBH4 poate fi transformat într-o celulă de combustibil.
NaBH4 în prezența unei soluții alcaline de KOH sau NaOH se hidrolizează și produce hidrogen HDouă care poate fi folosit ca combustibil într-o celulă de combustibil electrolit polimeric.
De asemenea, a fost investigat ca material de depozitare pentru HDouă reversibil.
Nanoparticulele NaBH sunt sintetizate4 și stabilizat cu un agent tensioactiv. După tratamentul cu NiClDouă se formează un strat sau acoperire de protecție care reglează eliberarea de HDouă complet reversibil.
Acest nou material nanometric ar permite utilizarea HDouă ca combustibil curat și regenerabil.

În industria celulozei și hârtiei
Borohidrura de sodiu este utilizată pentru a îmbunătăți luciul și alte proprietăți fizice ale celulozei și hârtiei..
Degradarea matricei celulozice a hârtiei are loc prin procese complexe care implică oxidare. Grupările hidroxil sunt oxidate în carbonil și carboxil, ceea ce duce la decolorarea hârtiei și la scăderea proprietăților sale fizice..
Când tratați celuloză sau hârtie cu NaBH4, Aceasta reduce aldehidele și cetonele la grupări -OH fără a afecta grupările carboxilice acide, îmbunătățind stabilitatea și luciul la valori mai mari decât inițiale..

În diverse utilizări
Borohidrura de sodiu este utilizată pentru tratarea apelor uzate, ca agent de îmbunătățire a aromei în industria alimentară și a băuturilor, ca agent de acoperire și pentru tratarea suprafeței, în producția de tutun, în industria farmaceutică, textilă și industrială..
Referințe
- Christian, M.L. și Aguey-Zinsou, K.-F. (2012). Strategia Core-Shell care conduce la o capacitate mare de stocare a hidrogenului reversibil pentru NaBH4. ACS Nano 2012, 6, 9, 7739-7751. Recuperat de la pubs.acs.org.
- Nora de Souza, M.V. și Alves V., T.R. (2006). Metodologii recente mediate de borohidrură de sodiu în reducerea diferitelor clase de compuși. App. Organometal. Chem.2006; 20: 798-810. Recuperat de la onlinelibrary.wiley.com.
- Imamoto, T. (1991). Reducere. Borohidrură de sodiu. În Sinteza organică cuprinzătoare. Recuperat de la sciencedirect.com.
- Tang, L.C. (1986) Stabilizarea hârtiei prin tratament cu borohidrură de sodiu. În materiale textile și hârtie istorice. Capitolul 24. Pagini 427-441. Progresele în chimie, volumul 212. Recuperat de la pubs.acs.org.
- Cotton, F. Albert și Wilkinson, Geoffrey. (1980). Chimie anorganică avansată. A patra editie. John Wiley & Sons.
- Morrison, Robert Thornton; și Boyd, Robert Neilson. 1992. Chimie organică. Prentice-Hall. ISBN 81-203-0765-8.
- S.U.A. Biblioteca Națională de Medicină. (2019). Borohidrură de sodiu. Recuperat de la: pubchem.ncbi.nlm.nih.gov.



Nimeni nu a comentat acest articol încă.