
Istoria bromului, structura, configurația electronică, proprietăți, utilizări
brom Este un element nemetalic care aparține grupului de halogeni, grupul 17 (VIIA) din Tabelul periodic. Simbolul său chimic este Br. Apare ca o moleculă diatomică, ai cărei atomi sunt legați printr-o legătură covalentă, pentru care i se atribuie formula moleculară BrDouă.
Spre deosebire de fluor și clor, bromul în condiții terestre nu este un gaz, ci un lichid maro-roșcat (imaginea de mai jos). Fumează și este împreună cu mercurul, singurele elemente lichide. Sub el, iodul, deși își intensifică culoarea și devine violet, se poate cristaliza într-un solid volatil.

Bromul a fost descoperit independent în 1825 de Carl Löwig, care studia sub conducerea chimistului german Leopold Gmelin; iar în 1826, de către chimistul francez Antoine-Jérome Balard. Cu toate acestea, publicarea rezultatelor experimentale ale lui Balard a precedat-o pe cea a lui Löwig..
Bromul este al 62-lea cel mai abundent element de pe Pământ, fiind distribuit în concentrații scăzute pe tot parcursul scoarței terestre. În mare, concentrația medie este de 65 ppm. Corpul uman conține 0,0004% brom, iar funcția sa nu este definitiv cunoscută..
Acest element este exploatat comercial în saramură sau în locuri care, din cauza condițiilor speciale, sunt locuri cu concentrație mare de săruri; de exemplu, Marea Moartă, spre care converg apele teritoriilor învecinate, saturate cu săruri.
Este un element coroziv capabil să atace metale, precum platina și paladiul. Dizolvat în apă, bromul își poate exercita și acțiunea corozivă asupra țesuturilor umane, agravând situația deoarece poate fi generat acid bromhidric. În ceea ce privește toxicitatea acestuia, poate provoca leziuni semnificative organelor, cum ar fi ficatul, rinichii, plămânii și stomacul.
Bromul este foarte dăunător în atmosferă, fiind de 40-100 de ori mai distructiv pentru stratul de ozon decât clorul. Jumătate din pierderea stratului de ozon din Antarctica este produsă de reacțiile legate de bromometil, un compus folosit ca fumigant.
Are numeroase utilizări, cum ar fi: ignifug, agent de albire, dezinfectant de suprafață, aditiv pentru combustibil, intermediar în fabricarea sedativelor, în fabricarea substanțelor chimice organice etc..
Indice articol
- 1 Istorie
- 1.1 Opera lui Carl Löwig
- 1.2 Opera lui Antoine Balard
- 2 Structura și configurația electronică a bromului
- 2.1 Molecula
- 2.2 Cristale
- 2.3 Stratul de valență și stările de oxidare
- 3 Proprietăți
- 3.1 Aspect fizic
- 3.2 Greutatea atomică
- 3.3 număr atomic
- 3.4 Miros
- 3.5 Punct de topire
- 3.6 Punctul de fierbere
- 3.7 Densitate (Br2) lichid
- 3.8 Solubilitate în apă
- 3.9 Solubilități
- 3.10 Punct triplu
- 3.11 Punct critic
- 3.12 Căldura de fuziune (Br2)
- 3.13 Căldura de vaporizare (Br2)
- 3.14 Capacitate termică molară (Br2)
- 3.15 Presiunea vaporilor
- 3.16 Temperatura de autoaprindere
- 3.17 Punct de aprindere
- 3.18 Temperatura de depozitare
- 3.19 Tensiunea superficială
- 3.20 Pragul mirosului
- 3.21 Indicele de refracție (ηD)
- 3.22 Electronegativitate
- 3.23 Energia de ionizare
- 3.24 Raza atomică
- 3.25 Raza covalentă
- 3.26 Raza Van der Waals
- 3.27 Reactivitate
- 4 utilizări
- 4.1 Aditiv pentru benzină
- 4.2 Pesticide
- 4.3 Controlul emisiilor de mercur
- 4.4 Fotografie
- 4.5 Acțiuni terapeutice
- 4.6 ignifug
- 4.7 Aditiv alimentar
- 4.8 Reactivi și intermediari chimici
- 4.9 Acțiune biologică
- 5 Unde se găsește
- 6 Riscuri
- 7 Referințe
Poveste
Opera lui Carl Löwig
Bromul a fost descoperit independent și aproape simultan de Carl Jacob Löwig, chimist german în 1825, și de Antoine Balard, chimist francez în 1826..
Carl Löwig, discipol al chimistului german Leopold Gmelin, a adunat apă dintr-un izvor din Bad Kreuznach și i-a adăugat clor; după adăugarea eterului, amestecul lichid a fost agitat.
Apoi, eterul a fost îndepărtat prin distilare și concentrat prin evaporare. Ca rezultat, el a obținut o substanță maro-roșiatică, care era brom.
Opera lui Antoine Balard
Balard, la rândul său, a folosit cenușa dintr-o algă brună cunoscută sub numele de fucus și a amestecat-o cu saramură, extrasă din sărurile din Montpellier. Astfel, el a eliberat bromul, făcând clorul să treacă prin materialul apos supus extracției, în care era prezentă bromura de magneziu, MgBr.Două.
Ulterior, materialul a fost distilat în prezența dioxidului de mangan și a acidului sulfuric, producând vapori roșii care s-au condensat într-un lichid întunecat. Balard a crezut că este un element nou și l-a numit muride, derivat din cuvântul latin muria, cu care a fost desemnată saramură.
S-a observat că Balard a schimbat numele din muride în brôme la sugestia Angladei sau Gay-Lussac, pe baza faptului că brôme înseamnă foul, care definește mirosul elementului descoperit..
Rezultatele au fost publicate de Belard în Annales of Chemie and Physique, înainte ca Löwig să le publice.
Abia din 1858 a fost posibil să se producă brom în cantități semnificative; anul a fost descoperite și exploatate zăcămintele de sare Stassfurt, producând brom ca produs secundar de potasiu.
Structura și configurația electronică a bromului
Moleculă

Imaginea superioară arată molecula de brom, BrDouă, cu un model compact de umplere. De fapt, există o legătură covalentă simplă între cei doi atomi de brom, Br-Br.
Fiind o moleculă omogenă și diatomică, îi lipsește un moment dipol permanent și nu poate interacționa decât cu altele de același tip prin intermediul forțelor de dispersie din Londra..
Acesta este motivul pentru care lichidul său roșiatic fumegează; în moleculele BrDouă, deși relativ grele, forțele lor intermoleculare le țin fără probleme.
Bromul este mai puțin electronegativ decât clorul și, prin urmare, are un efect mai puțin atractiv asupra electronilor din cojile de valență. Ca urmare, necesită mai puțină energie pentru a călători niveluri mai ridicate de energie, absorbind fotoni verzi și reflectând o culoare roșiatică..
Cristale
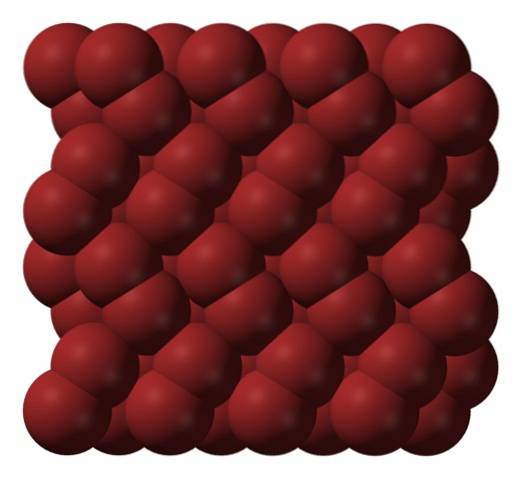
În faza gazoasă, moleculele BrDouă se separă considerabil până când nu există interacțiuni eficiente între ele. Cu toate acestea, sub punctul său de topire, bromul poate îngheța în cristale ortorombice roșiatice (imaginea de sus).
Rețineți modul în care moleculele BrDouă sunt aranjate îngrijit în așa fel încât să arate ca „viermi de brom”. Aici și la aceste temperaturi (T < -7,2°C), las fuerzas de dispersión son suficientes para que las vibraciones de las moléculas no desmoronen el cristal en el acto; pero aún así, varias de ellas sublimarán constantemente.
Stratul de valență și stările de oxidare
Configurația electronică a bromului este:
[Ar] 3d104sDouă 4p5
Fiind 3d104sDouă 4p5 învelișul său de valență (deși orbitalul 3d10 nu joacă un rol principal în reacțiile lor chimice). Electronii din orbitalii 4s și 4p sunt cei mai exteriori și adună un total de 7, doar un electron de la finalizarea octetului de valență.
Din această configurație se pot deduce posibilele stări de oxidare pentru brom: -1, dacă câștigă un electron pentru a fi izoelectronic pentru kripton; +1, rămânând ca 3d104sDouă 4p4; +3, +4 și +5, pierzând toți electronii din orbitalul 4p ([Ar] 3d104sDouă4p0); și +7, fără a lăsa electroni în orbitalul 4s ([Ar] 3d104s04p0).
Proprietăți
Aspectul fizic
Lichid fumuriu maroniu roșu închis Se găsește în natură ca o moleculă diatomică, cu atomii legați printr-o legătură covalentă. Bromul este un lichid mai dens decât apa și se scufundă în el.
Greutate atomica
79,904 g / mol.
Numar atomic
35.
Miros
Un fum înțepător, sufocant și iritant.
Punct de topire
-7,2 ºC.
Punct de fierbere
58,8 ºC.
Densitate (frDouă) lichid
3,1028 g / cm3
Solubilitatea apei
33,6 g / L la 25 ° C. Solubilitatea bromului în apă este scăzută și tinde să crească odată cu scăderea temperaturii; comportament similar cu celelalte gaze.
Solubilități
Liber solubil în alcool, eter, cloroform, tetraclorură de carbon, disulfură de carbon și acid clorhidric concentrat. Solubil în solvenți nepolari și polari cum ar fi alcoolul, acidul sulfuric și mulți solvenți halogenați.
Punct triplu
265,9 K la 5,8 kPa.
Punct critic
588 K la 10,34 MPa.
Căldura de fuziune (BrDouă)
10.571 kJ / mol.
Căldura de vaporizare (BrDouă)
29,96 kJ / mol.
Capacitatea de căldură molară (BrDouă)
75,69 kJ / mol.
Presiunea de vapori
La o temperatură de 270 K, 10 kPa.
Temperatură de autoaprindere
Nu este inflamabil.
punctul de aprindere
113 ºC.
Temperatura de depozitare
2-8 ° C.
Tensiune de suprafata
40,9 mN / m la 25 ° C.
Pragul mirosului
0,05-3,5 ppm. 0,39 mg / m3
Indicele de refracție (ηD)
1,6083 la 20 ° C și 1,6478 la 25 ° C.
Electronegativitate
2,96 pe scara Pauling.
Energie de ionizare
- Primul nivel: 1.139,9 kJ / mol.
- Al doilea nivel: 2.103 kJ / mol.
- Al treilea nivel: 3.470 kJ / mol.
Radio atomic
120 pm.
Raza covalentă
Ora 120.3.
Radio Van der Waals
185 pm.
Reactivitate
Este mai puțin reactiv decât clorul, dar mai reactiv decât iodul. Este un oxidant mai puțin puternic decât clorul și mai puternic decât iodul. Este, de asemenea, un agent reducător mai slab decât iodul, dar mai puternic decât clorul..
Vaporii de clor sunt foarte corozivi pentru multe materiale și țesuturi umane. Atacă multe elemente metalice, inclusiv platină și paladiu; dar nu atacă plumbul, nichelul, magneziul, fierul, zincul și sub 300 ° C nici sodiul.
Bromul din apă suferă o schimbare și se transformă în bromură. Poate exista și sub formă de bromat (BrO3-), în funcție de pH-ul lichidului.
Datorită acțiunii sale oxidante, bromul poate induce eliberarea de radicali liberi de oxigen. Aceștia sunt oxidanți puternici și pot provoca leziuni tisulare. De asemenea, bromul se poate aprinde spontan atunci când este combinat cu potasiu, fosfor sau staniu..
Aplicații
Aditiv pentru benzină
Dibromura de etilenă a fost utilizată pentru a elimina depozitele potențiale de plumb de la motoarele auto. După arderea benzinei, care folosea plumbul ca aditiv, bromul combinat cu plumbul formează bromura de plumb, un gaz volatil care a fost expulzat prin conducta de evacuare..
Deși bromul a îndepărtat plumbul din benzină, acțiunea sa distructivă asupra stratului de ozon a fost foarte puternică, motiv pentru care a fost aruncat pentru această aplicație.
Pesticide
Bromura de metilen sau bromometil a fost utilizată ca pesticid pentru a purifica solurile, în special pentru a elimina nematodele parazite, cum ar fi anghiloma..
Cu toate acestea, utilizarea majorității compușilor care conțin brom a fost eliminată datorită acțiunii lor distructive asupra stratului de ozon..
Controlul emisiilor de mercur
Bromul este utilizat în unele plante pentru a reduce emisia de mercur, un metal foarte toxic..
Fotografie
Bromura de argint, pe lângă iodura de argint și clorura de argint, este utilizată ca compus sensibil la lumină în emulsiile fotografice.
Acțiuni terapeutice
Bromura de potasiu, precum și bromura de litiu, au fost utilizate ca sedative generale în secolele XIX și începutul secolului XX. Bromurile sub formă de săruri simple sunt încă utilizate în unele țări ca anticonvulsivante.
Cu toate acestea, FDA din SUA nu aprobă astăzi utilizarea bromului pentru tratamentul oricărei boli..
Ignifug
Bromul este transformat de flăcări în acid bromhidric, care interferează cu reacția de oxidare care are loc în timpul incendiului și provoacă stingerea acestuia. Polimerii care conțin brom sunt folosiți pentru fabricarea rășinilor ignifuge.
Aditiv alimentar
Au fost adăugate urme de bromat de potasiu în făină pentru a îmbunătăți gătitul.
Reactivi și intermediari chimici
Bromura de hidrogen este utilizată ca agent reducător și catalizator pentru reacțiile organice. Bromul este utilizat ca intermediar chimic în fabricarea medicamentelor, fluidelor hidraulice, agenților de răcire, dezumidificatoarelor și în preparatele pentru ondularea părului..
De asemenea, găsește utilizare în producția de fluide de foraj de puțuri, produse pentru dezinfectarea apei, agenți de înălbire, dezinfectanți de suprafață, coloranți, aditivi pentru combustibil etc..
Acțiune biologică
Un studiu realizat în 2014 indică faptul că bromul este un cofactor necesar pentru biosinteza colagenului IV, ceea ce face din brom un element esențial pentru dezvoltarea țesuturilor animale. Cu toate acestea, nu există informații despre consecințele unui deficit al elementului.
Unde se află
Bromul este extras comercial din minele de sare și din gropile de saramură adânci găsite în statul Arkansas și în marele lac sărat al Utah, ambele în Statele Unite. Această ultimă saramură are o concentrație de brom de 0,5%.
Pentru a extrage bromul, clorul gazos fierbinte este adăugat în saramură pentru a oxida ionii de bromură din soluție, colectând bromul elementar..
Marea Moartă, la granița dintre Iordania și Israel, este o mare închisă care se află sub nivelul mării, ceea ce îl face să aibă o concentrație foarte mare de săruri.
Bromul și potasa se obțin acolo comercial, prin evaporarea apei bogate în sare din Marea Moartă. În această mare concentrația de brom poate ajunge la 5 g / L.
De asemenea, se găsește în concentrații mari în unele izvoare termale. Brominitul, de exemplu, este un mineral de bromură de argint găsit în Bolivia și Mexic..
Riscuri
Bromul în stare lichidă este coroziv pentru țesuturile umane. Dar cel mai mare pericol pentru om vine din vaporii de brom și inhalarea lor..
Respirația într-un mediu cu o concentrație de brom de 11-23 mg / m3 produce șocuri severe. O concentrație de 30-60 mg / m3 este extrem de nociv. Între timp, o concentrație de 200 mg poate fi fatală.
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Centrul Național pentru Informații despre Biotehnologie. (2019). Brom. Baza de date PubChem. CID = 23968. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Ross Rachel. (8 februarie 2017). Fapte despre brom. Recuperat de pe: livesscience.com
- Wikipedia. (2019). Borax. Recuperat de pe: en.wikipedia.org
- Lenntech B. V. (2019). Brom. Recuperat de pe: lenntech.com



Nimeni nu a comentat acest articol încă.