
Structura, proprietățile și utilizările butanonei
butanone este un compus organic, în special o cetonă, a cărui formulă chimică este CH3CHDouăMașină3. Aspectul său este acela al unui lichid incolor utilizat în principal ca solvent. Are proprietăți similare acetonei, dar fierbe la o temperatură mai ridicată și se evaporă mai lent.
Este produs prin deshidrogenarea catalitică a 2-butanolului (compus chiral). Cu toate acestea, se găsește în starea sa naturală în compoziția unor fructe. Face parte din fumurile din conductele de evacuare ale vehiculelor și este o componentă a fumului de tutun.
După acetonă este cel mai simplu din această familie de compuși organici. Butanona provoacă iritații la nivelul ochilor și nasului. La doze neobișnuit de mari poate provoca iritarea mucoasei pulmonare. Pe de altă parte, acest lichid este considerat un agent precursor al narcoticelor..
Butanona are o solubilitate mare în apă; dar este, de asemenea, foarte solubil în solvenți organici precum etanol, eter, acetonă, benzen și cloroform. Acest lucru ar putea fi explicat deoarece jurnalul dvs. de valoare P (0.29) pentru coeficientul de partiție octanic / apă este scăzut.
Indice articol
- 1 Structura butanonei
- 2 Proprietăți
- 2.1 Formula moleculară
- 2.2 Denumiri
- 2.3 Masa molară
- 2.4 Descrierea fizică
- 2.5 Miros
- 2.6 Punctul de fierbere
- 2.7 Punctul de topire
- 2.8 Punct de aprindere
- 2.9 Solubilitate în apă
- 2.10 Solubilitate în solvenți organici
- 2.11 Densitatea
- 2.12 Densitatea vaporilor
- 2.13 Presiunea vaporilor
- 2.14 Coeficientul de partiție octanol / apă
- 2.15 Temperatura de autoaprindere
- 2.16 Descompunerea
- 2.17 Vâscozitatea
- 2.18 Căldura de ardere
- 2.19 Căldura de vaporizare
- 2.20 Tensiunea superficială
- 2.21 Potențial de ionizare
- 2.22 Pragul mirosului
- 2.23 Indicele de refracție
- 2.24 Constanta de disociere
- 2.25 Stabilitate
- 3 utilizări
- 3.1 Solvent
- 3.2 Reactiv
- 3.3 Ciment plastic
- 3.4 Alte utilizări
- 4 Referințe
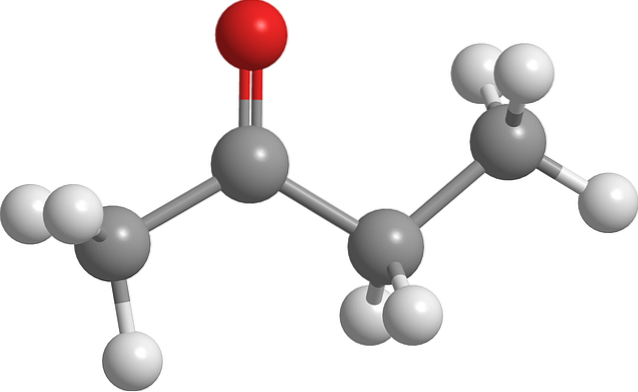
Structura butanonei
Imaginea de mai sus prezintă molecula de butanonă cu un model de bilă și stick. Atomul de oxigen al grupării carbonil (sfera roșie) poate fi văzut pe al doilea carbon. Acest grup, C = O, este responsabil pentru a da moleculei un moment dipol permanent.
Butanona, văzută structural, nu este altceva decât o acetonă la care s-a adăugat o grupare metilen, CHDouă. Deoarece există mai mulți atomi de carbon, momentul dipol este mai mic în comparație cu acetonă; dar masa sa moleculară mai mare îl face să fiarbă la o temperatură mai ridicată.
Această moleculă, ca și alte cetone, nu are capacitatea de a forma legături de hidrogen; și, prin urmare, interacțiunile lor dipol-dipol nu sunt la fel de puternice.
De aceea este un lichid volatil. Pe măsură ce temperatura scade (-86,6 ° C), dipolii săi slabi sunt cei care își orientează moleculele în mod ordonat pentru a forma un cristal. În plus, se poate comenta, de asemenea, că butanona este asimetrică din punct de vedere structural.
Proprietăți
Formulă moleculară
C4H8O sau CH3MașinăDouăCH3
Numele
- Butanone.
- 2-butanonă.
- Butan-2-one.
- Metil etil cetonă.
Masă molară
72,107 g / mol.
Descriere Fizica
Lichid incolor.
Miros
Menta parfumată, moderat puternică.
Punct de fierbere
79,59 ° C la 760 mmHg.
Punct de topire
-86,6 ºC.
punctul de aprindere
-9 ºC (cupă închisă).
Solubilitatea apei
29 g / 100 ml la 20 ° C. Deși momentul său dipolar este mai mic decât cel al acetonei, poate interacționa într-un grad excelent cu moleculele de apă. De la acestea primește legături de hidrogen: (CH3) (CHDouăCH3) C = O-HOH. Datorită acestui fapt, este foarte solubil în apă.
Solubilitate în solvenți organici
Solubil în benzen, alcool și eter; Miscibil cu uleiuri, etanol, eter, acetonă, benzen și cloroform. Rețineți că butanona este solubilă într-o mare varietate de solvenți.
Densitate
0,7997 g / cm3 la 25 ° C.
Densitatea vaporilor
2,41 (relativ la apă = 1).
Presiunea de vapori
90,6 mmHg la 25 ° C.
Coeficientul de partiție octanol / apă
Jurnal P = 0,29
Temperatură de autoaprindere
505 ºC.
Descompunere
Este descompus prin procese fotochimice prin oxidare de către radicalii hidroxil liberi, precum și prin descompunerea directă a fotolizei. Când este încălzit până la descompunere, emite fum acru.
Viscozitate
0,40 cPoise la 25 ° C.
Căldura de ardere
2.444,1 kJ / mol la 25 ° C.
Căldura de vaporizare
31,30 kJ / mol la punctul de fierbere; și 34,79 kJ / mol la 25 ° C.
Tensiune de suprafata
23,97 mN / m la 25 ° C.
Potențial de ionizare
0,54 eV.
Pragul mirosului
Miros redus: 0,735 mg / m3.
Miros ridicat: 147,5 mg / m3.
Indicele de refracție
1.788 la 20 ° C.
Constanta de disociere
pKa = 14,70.
Stabilitate
Stabil, dar foarte inflamabil. Incompatibil cu agenți oxidanți puternici, baze și agenți reducători. Umezeala trebuie evitată.
Aplicații
Solvent
Butanona este utilizată ca solvent în fabricarea acoperirilor de suprafață, fabricarea pulberilor fără fum, fabricarea rășinilor colorate și în îndepărtarea acumulării de grăsimi produse de lubrifianți.
În plus, este utilizat în elaborarea:
- Piele artificiala.
- Cauciucuri.
- Lacuri.
- Lacuri.
- Lipici.
- Solvenți.
- Detergenți de vopsea.
- Adezivi.
- Cimenturi din plastic.
- Etanșanți.
- Benzi magnetice.
- Hârtie transparentă.
- Cerneluri tipografice.
- Cosmetice și produse farmaceutice.
De asemenea, este utilizat ca solvent pentru degresarea suprafețelor metalice, pentru curățarea echipamentelor electronice și pentru extragerea grăsimilor. Este folosit pentru extragerea lemnului de esență tare și a uleiului vegetal.
Este un ingredient inert în fabricarea pesticidelor și în fabricarea acetatului de celuloză și a azotului de celuloză.
Este utilizat ca solvent de extracție în procesarea alimentelor și a ingredientelor alimentare; de exemplu, în fracționarea grăsimilor și uleiurilor, precum și în procesul de decofeinizare a cafelei. De asemenea, utilizat ca solvent în markere utilizate pe tablele albe.
Reactiv
- Butanona este utilizată ca fotoinitiator solubil în apă pentru fotopolimerizarea acidului metacrilic..
- Se condensează cu formaldehidă pentru a produce izopropenil cetonă.
- Experimentează autocondensarea pentru producerea etilamil cetonei.
- Reacționează cu citral pentru a obține componente de parfum, cum ar fi metilpseudoionona.
- Intervine ca catalizator în producția de hidrazină.
- În plus, este un precursor al peroxidului de metil etil cetonă, care este un catalizator pentru unele reacții de polimerizare..
Ciment plastic
Butanona se aplică ca agent de sudură din plastic, cu utilizare la asamblarea modelelor la scară din polistiren. Butanona dizolvă polistirenul, permițând marginile să se unească atunci când are loc o nouă polimerizare. Acest comportament este de ciment și nu de lipici.
Alte utilizări
Butanona este utilizată ca sterilizator de spori bacterieni în instrumente chirurgicale, ace, injectoare hipodermice și instrumente dentare..
Este utilizat ca agent aromatizant alimentar în concentrații foarte scăzute; de exemplu, în băuturile alcoolice concentrația este de 20 ppm; în produsele coapte, 12,7 ppm; carnea are în jur de 26,5 ppm; guma de mestecat, 0,63 ppm; iar în grăsimi și uleiuri, 1,0 ppm.
Și, în cele din urmă, butanona este utilizată în separarea apoproteinei de grupul hem în hemoproteine..
Referințe
- Morrison, R. T. și Boyd, R, N. (1987). Chimie organica. 5ta Ediție. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Chimie organica. (Ediția a șasea). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organica. Amine. (10aediție.). Wiley plus.
- Centrul Național pentru Informații despre Biotehnologie. (2019). Metil etil cetonă PubChem Database. CID = 6569. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Butanone. Recuperat de pe: en.wikipedia.org
- Societatea Regală de Chimie. (2015). Butanone. Chemspider. Recuperat de pe: chemspider.com
- Arlem Cheprasov. (2019). Ce este butanona? Formula și utilizările. Studiu. Recuperat de la: study.com
- Vasler Ben. (17 mai 2017). Butanone. Lumea chimiei. Recuperat de pe: chemistryworld.com



Nimeni nu a comentat acest articol încă.