
Structura calmodulinei, funcțiile și mecanismul de acțiune
Calmodulin este un termen care vine să însemne „proteină modulată cu calciu” și se referă la o mică proteină intracelulară care are proprietatea de a se lega de ionul de calciu (Ca ++) și de a media multe dintre acțiunile sale intracelulare. Originea cuvântului provine din combinația cuvintelor în engleză „calciu”, „modulat” și „proteină” care, atunci când sunt puse împreună, derivă în LĂMÂIE VERDEcium MODULated proteÎN.
Printre elementele minerale care devin parte a constituției organismelor animale, calciul, urmat de fosfor, este de departe cel mai abundent, deoarece osul este format prin depunerea în matricea sa de cantități mari de săruri minerale formate din acest ion.

Desigur, aceste săruri minerale ale calciului sunt esențiale pentru constituirea și conformarea sistemului osos al vertebratelor, dar forma ionizată a calciului (Ca ++) în soluție în fluidele corporale capătă o importanță fiziologică relevantă pentru viața animale.organisme.
Acest cation, cu două sarcini electrice pozitive în exces în structura sa, poate acționa ca purtător de curent prin deplasarea prin membrana celulară și modificarea nivelului său de potențial electric în multe dintre celulele excitabile ale corpului, în principal în mușchiul inimii..
Dar de o mai mare relevanță fiziologică este faptul că multe reacții de reglare celulare declanșate de stimuli externi, cum ar fi neurotransmițători, hormoni sau alți factori fizici sau biochimici, sunt specii de cascade metabolice la care participă secvențial mai multe proteine, dintre care unele sunt enzime care necesită calciu pentru activare sau inactivare.
Se spune atunci în aceste cazuri că calciul acționează ca un al doilea mesager într-o cascadă metabolică destinată să aibă un rezultat final care să ajungă ca răspunsul celular necesar pentru a satisface o nevoie detectată la un alt nivel diferit de cel al celulei în sine, și că necesită de la ea acel răspuns special.
Calciul poate acționa direct asupra țintei sale biochimice pentru a-i influența activitatea, dar de multe ori necesită participarea unei proteine cu care trebuie să se lege pentru a-și exercita efectul asupra proteinelor care trebuie modificate. Calmodulina este una dintre acele proteine mediator.
Indice articol
- 1 Structură
- 2 Funcțiile calmodulinei
- 3 Mecanismul de acțiune
- 3.1 Calmodulină și contracția mușchilor netezi
- 3.2 Adaptarea la senzorii olfactivi
- 4 Calmodulin în plante
- 5 Referințe
Structura
Calmodulina, foarte omniprezentă, deoarece este exprimată în aproape toate tipurile de celule ale organismelor eucariote, este o proteină acidă mică, cu o greutate moleculară de aproximativ 17 kDa, a cărei structură este foarte conservată în rândul speciilor..
Este o proteină monomerică, adică este alcătuită dintr-un singur lanț polipeptidic, care la capetele sale terminale ia forma unor domenii globulare unite printr-o helix alfa. Fiecare domeniu globular are două motive cunoscute sub numele de mână EF. EF mână) care sunt tipice proteinelor care leagă calciu.
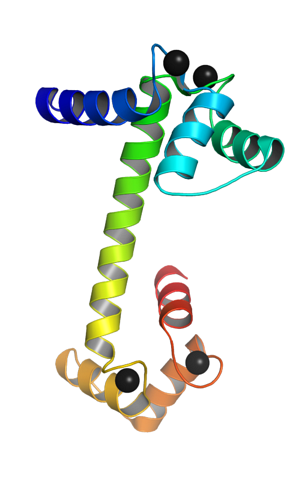
Aceste motive topologice „mână EF” reprezintă un fel de structuri supersecundare; sunt legate între ele, în fiecare domeniu globular, de o regiune de mare flexibilitate și în fiecare dintre ele există un situs de legare pentru Ca ++, care produce 4 site-uri în total pentru fiecare moleculă de calmodulină.
Legarea ionilor de calciu încărcați pozitiv este posibilă prin prezența reziduurilor de aminoacizi cu lanțuri laterale încărcate negativ la siturile de legare a calciului ale calmodulinei. Aceste reziduuri sunt trei aspartati și un glutamat..
Funcțiile calmodulinei
Toate funcțiile cunoscute până acum pentru calmodulină sunt încadrate într-un grup de acțiuni promovate de creșterea calciului citosolic produsă de intrarea sa din spațiul extracelular sau ieșirea sa din depozitele intracelulare: mitocondriile și reticulul endoplasmatic.
Multe dintre acțiunile calciului sunt efectuate de acest ion acționând direct asupra proteinelor sale țintă, care pot avea diferite tipuri și funcții. Unele dintre aceste proteine nu pot fi influențate direct, dar necesită calciu pentru a se lega de calmodulină și acest complex acționează asupra proteinei influențate de ion..
Se spune că aceste proteine țintă sunt dependente de calciu-calmodulină și includ zeci de enzime, cum ar fi protein kinaze, proteine fosfataze, nucleotide ciclase și fosfodiesteraze; toți implicați într-o multitudine de funcții fiziologice, inclusiv:
- Metabolism
- Transportul particulelor
- Mobilitate viscerală
- Secreția de substanțe
- Fertilizarea ovulelor
- Expresia genelor
- Proliferarea celulelor
- Integritatea structurală a celulelor
- Comunicare intercelulară etc.
Printre protein kinazele dependente de calmodulină se numără: kinaza lanțului ușor miozinic (MLCK), fosforilaza kinază și Ca ++ / calmodulin kinazele I, II și III.
Astfel, informațiile codificate de semnalele de calciu (creșterea sau scăderea concentrației sale intracelulare) sunt „decodate” de aceasta și de alte proteine care leagă calciu, care transformă semnalele în modificări biochimice; Cu alte cuvinte, calmodulina este o proteină intermediară în procesele de semnalizare dependente de calciu.
Mecanism de acțiune
Calmodulina este o proteină foarte versatilă, deoarece proteinele sale „țintă” sunt considerabil diverse ca formă, secvență, dimensiune și funcție. Deoarece este o proteină care funcționează ca un „senzor” pentru ioni de calciu, mecanismul său de acțiune depinde de modificările induse în structura și / sau conformația sa odată ce se leagă de patru dintre acești ioni..
Mecanismele sale de acțiune pot fi exemplificate prin revizuirea succintă a participării sale la câteva procese fiziologice, cum ar fi contracția mușchiului neted visceral și adaptarea la mirosurile suferite de celulele de păr ale mucoasei olfactive din nas..
Contracția calmodulinei și a mușchilor netezi
Contracția mușchilor scheletici și cardiaci este declanșată atunci când creșterea Ca ++ citosolică atinge niveluri peste 10-6 mol / l și acest ion se leagă de troponina C, care suferă modificări alosterice care afectează tropomiozina. La rândul său, tropomiozina se mișcă și își expune locurile de legare a miozinei în actină, ducând la declanșarea procesului contractil..
Troponina C nu există în mușchiul neted, iar creșterea Ca ++ peste nivelul indicat promovează legarea sa cu calmodulină. Complexul Ca-calmodulină activează miozina lanțului ușor kinazei (MLCK), care la rândul său fosforilează acest lanț ușor, activează miozina și declanșează procesul contractil..
Creșterea Ca ++ are loc prin intrarea sa din exterior sau ieșirea sa din reticulul sarcoplasmatic prin acțiunea inozitol trifosfatului (IP3) eliberat de fosfolipaza C în cascadă activată de receptori cuplați la proteina Gq. Relaxarea apare atunci când Ca ++, prin acțiunea transportorilor, este îndepărtat din citosol și revine la locurile sale de origine.
O diferență importantă între ambele tipuri de contracție este că în mușchii striați (cardiaci și scheletici) Ca ++ induce modificări alosterice prin legarea cu proteina sa, troponina, în timp ce la mușchii netezi modificările produse de Ca-calmodulină sunt covalente și implică fosforilarea miozinei.
Prin urmare, odată ce acțiunea Ca ++ s-a încheiat, este necesară participarea unei alte enzime pentru a elimina fosfatul adăugat de kinază. Această nouă enzimă este miozina fosfatază cu lanț ușor (MLCP) a cărei activitate nu depinde de calmodulină, dar este reglementată de alte căi.
În realitate, procesul contracțional al mușchiului neted nu încetează complet, dar gradul de contracție rămâne la un nivel intermediar ca urmare a echilibrului acțiunilor ambelor enzime, MLCK controlat de Ca ++ și calmodulină și MLCP supus altor controale de reglementare.
Adaptare în senzori olfactivi
Senzația mirositoare este declanșată atunci când receptorii olfactivi localizați în cilii celulelor situate pe suprafața mucoasei olfactive sunt activate..
Acești receptori sunt cuplați la o proteină G heterotrimerică cunoscută sub numele de "Golf" (proteină G olfactivă), care are trei subunități: "αolf", "ß" și "γ".
Când receptorii olfactivi sunt activați ca răspuns la un miros, subunitățile acestei proteine se disociază și subunitatea „αolf” activează enzima adenil ciclază, producând adenozin monofosfat ciclic (AMPc)..
CAMP activează canalele asemănătoare GNC (activate de nucleotide ciclice) pentru calciu și sodiu. Acești ioni intră în celulă, o depolarizează și determină inițierea potențialelor de acțiune a căror frecvență va determina intensitatea mirosului..
Calciul care intră, care tinde să depolarizeze celula, are un efect antagonist de feedback negativ, oarecum mai târziu, prin legarea de calmodulină și între ele închiderea canalului și eliminarea stimulului depolarizant, chiar dacă stimulul mirositor persistă. Aceasta se numește adaptarea senzorului.
Calmodulin în plante
Plantele răspund, de asemenea, la diferențele în concentrația intracelulară a ionilor de calciu prin intermediul proteinelor calmoduline. În aceste organisme, calmodulinele împărtășesc multe caracteristici structurale și funcționale cu omologii lor la animale și drojdii, deși diferă în unele aspecte funcționale..
De exemplu, calmodulina din plante se leagă de secvențe scurte de peptide din proteinele țintă, inducând modificări structurale care își modifică activitățile ca răspuns la variațiile interne ale calciului..
În ce măsură calmodulina controlează procese similare cu cele care apar la animale la plante este ceva care rămâne o chestiune de discuție astăzi..
Referințe
- Brenner B: Musculatur, în: Fiziologie, Ediția a 6-a; R Klinke și colab. (Eds). Stuttgart, Georg Thieme Verlag, 2010.
- Ganong WF: Bazele celulare și moleculare ale fiziologiei medicale, în: Revizuirea fiziologiei medicale, Ediția a 25-a. New York, McGraw-Hill Education, 2016.
- Guyton AC, Sala JE: Introducere în endocrinologie, în: Manual de fiziologie medicală, Ediția a 13-a, AC Guyton, JE Hall (ed.). Philadelphia, Elsevier Inc., 2016.
- Kaup UB, Müller F: Olfactorisches System, In: Physiologie, 4th ed; P Deetjen și colab. (Eds). München, Elsevier GmbH, Urban & Fischer, 2005.
- Korbmacher C, Greger R, Brenner B, Silbernagl S: Die Zelle als Grundbaustein, în: Fiziologie, Ediția a 6-a; R Klinke și colab. (Eds). Stuttgart, Georg Thieme Verlag, 2010.
- Zielinski, R. E. (1998). Calmodulină și proteinele care se leagă de calmodulină în plante. Revizuirea anuală a biologiei plantelor, 49 (1), 697-725.


Nimeni nu a comentat acest articol încă.