
Structura, proprietățile, utilizările carbonatului de litiu (Li2CO3)

carbonat de litiu este un solid anorganic format din doi cationi Li de litiu+ și un anion carbonat CO3Două-. Formula sa chimică este LiDouăCO3. LiDouăCO3 este un solid cristalin alb care poate fi obținut prin reacția dintre hidroxidul de litiu și dioxidul de carbon.
Carbonatul de litiu are un punct de topire foarte ridicat, motiv pentru care este utilizat la prepararea paharelor, ceramicii și porțelanurilor. Are o mare varietate de utilizări, cum ar fi bateriile reîncărcabile cu litiu, la prepararea altor compuși de litiu, la electrozii de sudură și la vopsele și lacuri..

Se folosește și LiDouăCO3 în amestecuri de ciment pentru fixare rapidă și producție de aluminiu.
Una dintre cele mai importante utilizări ale sale este în tratamentul unor boli mintale, cum ar fi depresia și comportamentele excesiv de agresive, printre alte afecțiuni..
Cu toate acestea, utilizarea acestuia ca medicament trebuie controlată în mod corespunzător de către specialiștii medicali, deoarece persoanele tratate cu LiDouăCO3 poate suferi efecte dăunătoare asupra sănătății dumneavoastră, cum ar fi hipotiroidismul (funcția redusă a glandei tiroide).
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți fizice
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Punctul de topire
- 3.4 Descompunerea
- 3.5 Densitate
- 3.6 Solubilitate
- 3,7 pH
- 4 Proprietăți chimice
- 5 Proprietăți biologice
- 6 Obținerea
- 7 utilizări
- 7.1 În tratamentul bolilor mintale
- 7.2 În tratamentul simptomelor altor boli
- 7.3 Mod de administrare
- 8 Efecte adverse
- 8.1 Cazuri în care nu trebuie administrat
- 9 Alte utilizări
- 10 Referințe
Structura
Carbonatul de litiu este alcătuit din doi cationi de litiu Li+ și un anion carbonat CO3Două-.
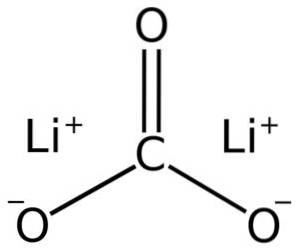
Configurația electronică a litiului în stare de oxidare +1 este 1sDouă 2s0, deoarece a pierdut electronul ultimei cochilii, fiind astfel mai stabil. Ionul carbonat CO3Două- are o structură plană.
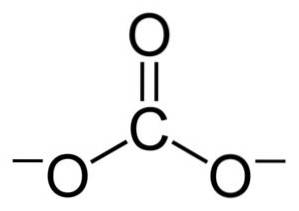
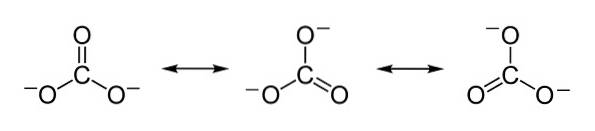
Sarcinile negative sunt distribuite în mod egal între cei trei atomi de oxigen ai ionului carbonat CO3Două-.
Nomenclatură
-Carbonat de litiu
-Carbonat de dilitiu
Proprietăți fizice
Starea fizică
Solid cristalin alb cu structură monoclinică
Greutate moleculară
73,9 g / mol
Punct de topire
723 ºC
Descompunere
Se descompune la 1300 ºC.
Densitate
2,11 g / cm3
Solubilitate
Ușor solubil în apă: 1,31% în greutate la 20 ° C. Solubilitatea sa în apă scade odată cu creșterea temperaturii. Este solubil în acizi diluați. Este insolubil în alcool și acetonă.
pH
Soluțiile din apă sunt alcaline, au un pH mai mare de 7.
Proprietăți chimice
LiDouăCO3 hidrolizează în soluție apoasă generând o soluție de bază. Proporția mică de compus care este solubilizat în apă lasă anionul carbonat CO liber.3Două-.
Anionul carbonat CO3Două- liber în soluție apoasă ia un proton pentru a forma anionul bicarbonat HCO3-, așa cum se poate observa în următoarea reacție:
CO3Două- + HDouăO → HCO3- + Oh-
Prezența ionilor OH- ceea ce face soluția de bază.
Proprietăți biologice
Urmele de ion litiu sunt prezente în mod normal în țesuturile animale și umane, dar până acum nu se cunoaște niciun rol fiziologic natural al acestui ion..
În organismul uman LiDouăCO3 ingerat ca medicament, acționează asupra unei varietăți de mecanisme de semnalizare în neuroni și alte celule. Acest lucru rezultă din înlocuirea cationilor precum sodiul și potasiul.
Incorporarea ionului de litiu în structura membranei celulare poate modifica răspunsul la hormoni și cuplarea celulei cu procesele energetice.
În acest fel, litiul modifică mai multe procese celulare, inclusiv metabolismul..
Prin modificarea modului în care funcționează celulele, LiDouăCO3 poate acționa asupra mecanismelor de comunicare ale neuronilor din creier.
Obținerea
LiDouăCO3 poate fi obținut prin reacția hidroxidului de litiu LiOH cu dioxidul de carbon CODouă, așa cum se arată mai jos:
2 LiOH + CODouă → LiDouăCO3 + HDouăSAU
Este produs comercial din minerale care conțin litiu, cum ar fi spodumen și lepidolit. Aceste minerale sunt tratate la temperaturi ridicate cu anumite săruri de sulfat sau cu compuși alcalini pentru a obține săruri de litiu..
Sărurile de litiu obținute sunt purificate cu apă sau soluții acide și apoi tratate cu carbonați pentru a forma LiDouăCO3.
Cu toate acestea, LiDouăCO3 Realizat în acest fel, este contaminat cu sulfați sau cloruri de calciu, magneziu, fier, sodiu, potasiu etc. deci necesită o purificare suplimentară.
Aplicații
În tratamentul bolilor mintale
Este utilizat ca agent antidepresiv, antimanic, în tratamentul comportamentelor agresiv-impulsive și pentru tulburările bipolare (persoanele care își schimbă brusc dispoziția fără nici o cauză, devenind violente).

Medicii au observat că administrarea acestuia duce la o scădere a intensității și frecvenței perioadelor severe de depresie și a episoadelor maniacale..
Se utilizează singur, adică fără niciun compus adăugat, în terapia de întreținere a depresiei unipolare și pentru tulburarea schizoafectivă. De asemenea, servește la creșterea efectului antidepresiv al altor medicamente.
Deși a fost utilizat pentru a trata copiii cu simptome aparente de tulburare bipolară și hiperactivitate cu componente nevrotice sau agresive, nu a fost eficient în toate cazurile..
În tratarea simptomelor altor boli
Se utilizează pentru a reduce frecvența durerilor de cap severe, recurente și cronice.
Se utilizează pentru a reduce incidența infecției la pacienții cu neutropenie indusă de chimioterapie sau din alte motive. Neutropenia este o scădere a neutrofilelor, un tip de celule albe din sânge care ajută la combaterea infecțiilor din organism.
A fost utilizat ca inhibitor al enzimei tiroidiene pentru tratamentul hipertiroidiei, dar nu este tratamentul preferat datorită efectelor sale adverse.
Forma de administrare
Se utilizează sub formă de tablete sau capsule de LiDouăCO3. De asemenea, în comprimate cu eliberare lentă, cu citrat de litiu. Li este preferatDouăCO3 deoarece nu irită gâtul la înghițire, așa cum este cazul altor săruri de litiu.

Efecte adverse
LiDouăCO3 poate avea un efect dăunător asupra tiroidei și rinichilor, astfel încât funcția acestor organe trebuie monitorizată înainte și în timpul tratamentului cu acest compus..
LiDouăCO3 poate fi toxic la concentrații foarte apropiate de cele utilizate în tratamentele medicale, de aceea este necesară o revizuire continuă a valorilor sale în serul sanguin.
Simptomele otrăvirii cu LiDouăCO3 sunt tremurături, spasme musculare, slăbiciune musculară, diaree, vărsături, somnolență sau ataxie (afectarea coordonării musculare), printre altele.
La începerea terapiei cu LiDouăCO3 De asemenea, pot apărea simptome precum tremurături, dureri de cap și greață. Dar acestea tind să dispară pe măsură ce medicamentul continuă..
Majoritatea persoanelor tratate pot dezvolta, de asemenea, leucocitoză (o creștere a numărului de celule albe din sânge), dar aceasta este reversibilă..
Oamenii cărora li se administrează medicamente cu LiDouăCO3 nu ar trebui să conducă vehicule sau să opereze utilaje, deoarece coordonarea fizică și capacitatea de a efectua activități care necesită vigilență scad.
Cazuri în care nu trebuie administrat
Nu trebuie utilizat la copii cu vârsta sub 12 ani, deoarece poate interfera cu formarea oaselor și densitatea acestora, deoarece modifică concentrațiile unui hormon tiroidian. De asemenea, tinde să ia locul calciului în oase..
Nu trebuie tratați cu LiDouăCO3 persoanele cu boli cardiovasculare, renale sau tiroidiene. Nici la pacienții sever deshidratați.
Nu trebuie administrat gravidelor mai ales în primul trimestru de sarcină. Litiul traversează placenta și poate ajunge cu ușurință la făt cu posibile efecte teratogene, adică poate provoca anomalii sau malformații la copilul nenăscut..
Persoanele în vârstă care necesită tratament cu LiDouăCO3 trebuie tratat cu mare atenție și cu doze mai mici decât cele ale adulților tineri, deoarece pot dezvolta boli hipotiroidiene.
Alte utilizări
LiDouăCO3 puritatea ridicată este utilizată pe scară largă la fabricarea bateriilor cu litiu reîncărcabile.
Se utilizează în pilele de combustibil carbonat topit.
Se folosește la fabricarea porțelanului electric, care este un tip de porțelan izolant electric. Este, de asemenea, utilizat în producția de glazură pe ceramică.

Permite prepararea ceramicii cu un coeficient de expansiune redus, adică se extinde foarte puțin odată cu creșterea temperaturii, astfel încât ceramica poate fi utilizată într-un interval de temperatură mai mare.
Alte utilizări sunt ca catalizator, în fabricarea altor compuși de litiu, ca acoperire pentru electrozi de sudură, în formule de vopsea luminiscentă, lacuri și coloranți, precum și în producția electrolitică de aluminiu..
Este util să generați o setare mai rapidă a cimentului și este adăugat la lipiciul plăcilor, astfel încât acestea să poată fi fixate într-un timp scurt.

Referințe
- Cai, W. și colab. (2018). Eliminarea SO4Două- din LiDouăCO3 prin recristalizare în NaDouăCO3. Cristale 2018, 8, 19. Recuperat de pe mdpi.com.
- Gadikota, G. (2017). Conectarea modificărilor structurale morfologice și cristaline în timpul conversiei monohidratului de hidroxid de litiu în carbonat de litiu utilizând măsurători de dispersie cu raze X pe mai multe scări. Minerale 2017, 7, 169. Recuperat de pe mdpi.com.
- S.U.A. Biblioteca Națională de Medicină. (2019). Carbonat de litiu. Recuperat de la: pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Enciclopedia Tehnologiei Chimice. A patra editie. John Wiley & Sons.
- Enciclopedia lui Ullmann de chimie industrială. (1990). Ediția a cincea. VCH Verlagsgesellschaft mbH.
- Cotton, F. Albert și Wilkinson, Geoffrey. (1980). Chimie anorganică avansată. A patra editie. John Wiley & Sons.



Nimeni nu a comentat acest articol încă.