
Structura carbonatului de potasiu (K2CO3), proprietăți, utilizări, producție

Carbonat de potasiu este un compus anorganic format din doi ioni K de potasiu+ și un ion carbonat CO3Două-. Formula sa chimică este KDouăCO3. Este un solid alb higroscopic, adică absoarbe cu ușurință apa din mediu. Din acest motiv, în laboratoare este folosit pentru a absorbi apa din alte substanțe..
Este foarte solubil în apă, formând soluții alcaline, care sunt bogate în ioni OH.-și, prin urmare, cu o valoare pH ridicată. Soluțiile sale apoase, fiind alcaline, sunt utilizate în diverse procese industriale pentru a absorbi gazele acide, cum ar fi dioxidul de carbon CODouă și hidrogen sulfurat HDouăDa, îi neutralizează ușor.

K-ulDouăCO3 Se folosește pentru a prepara săpunuri, produse de curățat, detergenți pentru rufe și amestecuri de spălat vase. Este, de asemenea, utilizat în prelucrarea unor fibre textile, cum ar fi lână..
Este utilizat pe scară largă în laboratoarele de chimie, de exemplu pentru a absorbi apa din alți compuși sau pentru alcalinizarea amestecurilor de reacții chimice și, de asemenea, în analiza chimică.
De asemenea, se adaugă la unele alimente, de exemplu, pentru a elimina gustul amar al boabelor de cacao în timpul producției de ciocolată..
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Punctul de topire
- 3.4 Punctul de fierbere
- 3.5 Densitate
- 3.6 Solubilitate
- 3,7 pH
- 3.8 Proprietăți chimice
- 4 Obținerea
- 5 utilizări
- 5.1 În absorbția CO2 în procesele industriale
- 5.2 În eliminarea H2S din anumite procese
- 5.3 În laboratoarele de chimie
- 5.4 În industria produselor de curățare
- 5.5 În industria alimentară
- 5.6 În îngrășăminte
- 5.7 În diverse aplicații
- 6 Referințe
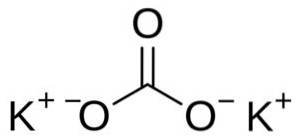
Structura
Carbonatul de potasiu este alcătuit din doi cationi de potasiu K+ și un anion carbonat CO3Două-. Anionul carbonat are o structură plană și simetrică, în timp ce cei trei atomi de oxigen înconjoară carbonul formând un triunghi plat..
Nomenclatură
- Carbonat de potasiu
- Carbonat de potasiu
- Carbonat de dipotasiu
- Potasă
- Sarea de potasiu a acidului carbonic.
Proprietăți
Starea fizică
Solid cristalin incolor până la alb.
Greutate moleculară
138,205 g / mol.
Punct de topire
899 ºC.
Punct de fierbere
Se descompune.
Densitate
2,29 g / cm3
Solubilitate
Foarte solubil în apă: 111 g / 100 g apă la 25 ° C. Insolubil în etanol și acetonă.
pH
O soluție apoasă poate avea un pH de 11,6, adică este destul de alcalină.
Proprietăți chimice
Carbonatul de potasiu este deliquescent sau higroscopic, adică absoarbe umezeala din mediu. Are un hidrat stabil, KDouăCO3.2HDouăSAU.
K-ulDouăCO3 în soluție apoasă se hidrolizează, adică reacționează cu apă eliberând grupe OH- care sunt cele care dau alcalinitate soluțiilor:
CO3Două- + HDouăO ⇔ OH- + HCO3-
HCO3- + HDouăO ⇔ OH- + HDouăCO3
Obținerea
Se poate obține din cenușa care rămâne la arderea plantelor. De asemenea, prin carbonatarea hidroxidului de potasiu KOH, adică prin adăugarea excesului de dioxid de carbon CODouă la KOH:
KOH + CODouă → KHCO3
2 KHCO3 + căldură → KDouăCO3 + HDouăSAU
O altă modalitate de obținere a acestuia este prin încălzirea clorurii de potasiu KCl cu carbonat de magneziu MgCO3, apă și CODouă sub presiune. Se obține mai întâi o sare dublă hidratată de magneziu și potasiu MgCO3.KHCO3.4HDouăSau, numită sare Engels:
2 KCI + 3 MgCO3 + CODouă + 5 oreDouăO → MgCO3.KHCO3.4HDouăO ↓ + MgClDouă
Sarea dublă hidratată Engels precipită și este filtrată din soluție. Apoi se încălzește și se formează carbonatul de potasiu KDouăCO3 că la adăugarea de apă se dizolvă în timp ce carbonatul de magneziu MgCO3 rămâne insolubil și este îndepărtat prin filtrare.
MgCO3.KHCO3.4HDouăO + căldură → MgCO3↓ + 2K+ + CO3Două- + CODouă↑ + 9 HDouăSAU
Aplicații
În absorbția CODouă în procesele industriale
Soluția de carbonat de potasiu este tratamentul clasic pentru îndepărtarea dioxidului de carbon CODouă în diverse procese, în special în aplicații de înaltă presiune și temperatură ridicată.

Îndepărtarea CODouă apare conform următoarei reacții:
KDouăCO3 + CODouă + HDouăO ⇔ 2 KHCO3
Această metodă este utilizată de exemplu pentru tratarea gazelor naturale. De asemenea, în centralele de producere a energiei electrice, pentru a evita emisia de CODouă în atmosferă și în producerea de gheață uscată.

Soluția lui KDouăCO3 poate fi regenerat termic, adică prin încălzire la temperaturi de aproximativ 100 ° C.
Pentru ca soluția de carbonat de potasiu să poată absorbi CO2 la o viteză bună, se adaugă promotori care accelerează procesul, cum ar fi dietanolamina (DEA)..
În îndepărtarea HDouăS a anumitor procese
Soluțiile de carbonat de potasiu sunt, de asemenea, utilizate pentru îndepărtarea hidrogenului sulfurat gazos HDouăS pentru fluxurile de proces. Uneori se adaugă trifosfat de potasiu K3PO4 pentru a face procesul mai rapid.
În laboratoarele de chimie
K-ulDouăCO3 Permite efectuarea de sinteze organice, de exemplu în reacții de condensare și neutralizare. Se utilizează pentru îndepărtarea apei din lichidele organice, ca agent de deshidratare sau deshidratant în laborator.
Este, de asemenea, utilizat în reacții chimice analitice și pentru alcalinizare în industria farmaceutică..
În industria produselor de curățare
K-ulDouăCO3 Se folosește pentru a face săpun, formule de curățare, rufe și produse de spălat vase, precum și pentru a pregăti șampon și alte produse de îngrijire personală.

În industria alimentară
Carbonatul de potasiu este adăugat în diferite alimente în diverse scopuri.
De exemplu, se adaugă boabelor de cacao pentru a le elimina gustul amar și a le folosi în producția de ciocolată. Se adaugă strugurilor în procesul de uscare pentru a obține stafide.

În patiserie este folosit ca agent de dospire (care acționează ca o drojdie) pentru făină pentru prepararea produselor coapte..

În îngrășăminte
K-ulDouăCO3 Se folosește pentru fertilizarea solurilor acide, deoarece ionul carbonat CO3Două- în contact cu apa produce ioni OH- care cresc pH-ul solului. Plus potasiu K+ este un nutrient pentru plante.
Carbonatul de potasiu a fost folosit și pentru fabricarea îngrășămintelor cu eliberare lentă.
Un îngrășământ cu eliberare lentă eliberează sau eliberează nutrienți încet, astfel încât să nu fie dizolvați și spălați. Datorită acestui fapt, vor putea petrece mai mult timp la dispoziția rădăcinilor plantei.
În diverse aplicații
Carbonat de potasiu KDouăCO3 este, de asemenea, folosit pentru:
- Procese de vopsire, albire și curățare a lânii brute și alte activități din industria textilă
- Obținerea altor săruri organice și anorganice de potasiu, cum ar fi cianura de potasiu KCN.
- Funcționează ca un regulator al acidității în diferite procese.
- Fabricarea ceramicii și olăritului.
- Procese de gravare și litografie.
- Tăierea și finisarea pieilor.
- Pregătiți cerneluri pentru imprimare, pigmenți.
- Fabricați ochelari special pentru televiziune, încă de la KDouăCO3 este mai compatibil decât carbonatul de sodiu NaDouăCO3 cu oxizi de plumb, bariu și stronțiu conținuți în aceste pahare.
- Tratamentul apei.
- Ignifug (sub formă de soluții apoase).
- Inhibați coroziunea și ca agent antivegetativ în echipamentele de proces.
Referințe
- S.U.A. Biblioteca Națională de Medicină. (2019). Carbonat de potasiu. Recuperat de la pubchem.ncbi.nlm.nih.gov.
- Steele, D. (1966). Chimia elementelor metalice. Pergamon Press Ltd. Londra.
- Mokhatab, S. și colab. (2019). Tratarea gazelor naturale. Soluția de carbonat de potasiu. În Manualul de transport și prelucrare a gazelor naturale (ediția a patra). Recuperat de la sciencedirect.com.
- Kakaras, E. și colab. (2012). Sisteme de cicluri combinate cu combustie în pat fluidizat sub presiune (PFBC). Combustie în pat fluidizat sub presiune cu captare și stocare a carbonului. În sistemele de cicluri combinate pentru generarea de energie cu emisii aproape zero. Recuperat de la sciencedirect.com.
- Speight, J.G. (2019). Producția de hidrogen. Spălare umedă. În recuperarea și modernizarea petrolului greu. Recuperat de la sciencedirect.com.
- Branan, C.R. (2005). Tratarea gazului: capitol actualizat de Chris Higman. Procese cu carbonat fierbinte. În Regulile de degetului mare pentru inginerii chimici (ediția a patra). Recuperat de la sciencedirect.com.
- Kirk-Othmer (1994). Enciclopedia Tehnologiei Chimice. A patra editie. John Wiley & Sons.
- Enciclopedia lui Ullmann de chimie industrială. (1990). Ediția a cincea. VCH Verlagsgesellschaft mbH.
- Li, Y. și Cheng, F. (2016). Sinteza unui nou îngrășământ de potasiu cu eliberare lentă din zgură de magneziu Pidgeon modificată de carbonat de potasiu. J Air Waste Manag Assoc, 2016 aug; 66 (8): 758-67. Recuperat de la ncbi.nlm.nih.gov.


Nimeni nu a comentat acest articol încă.