
Notare nucleară Carbon 12, istorie, comentarii
carbon-12 este cel mai abundent izotop al elementului carbon, cu 98,93% din abundență. În plus, este principalul responsabil pentru toate proprietățile și aplicațiile atribuite elementului carbon..
12C, cu o masă atomică de exact 12 daltoni, servește drept referință pentru stabilirea maselor atomice ale restului de nuclizi. Atomul de 12C este format din șase protoni, neutroni și electroni; cu toate acestea, masa electronilor este considerată neglijabilă.
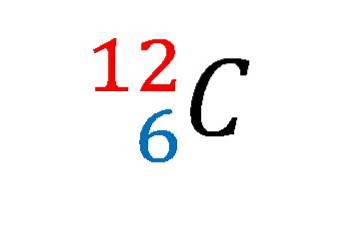
Elementele au de obicei mase atomice exprimate ca numere întregi, urmate de zecimale, deoarece elementele pot avea mai mulți izotopi stabili.
Prin urmare, masele atomice ale elementelor sunt exprimate ca media ponderată a maselor atomice ale diferiților lor izotopi. Având în vedere că 12C are o abundență de 98,93%, iar 13C o abundență de 1,15%, masa atomică a carbonului este de 12,011 daltoni.
Masa atomică a unui element este exprimată ca medie a masei atomice a diferiților săi atomi în raport cu o doisprezecime din masa elementului. 12C, cunoscut sub numele de unitate de masă atomică unificată; prescurtat anterior ca "uma" și în prezent ca "u".
Indice articol
- 1 Notare nucleară
- 2 Istorie
- 3 Comentarii generale
- 4 Referințe
Notare nucleară
În imaginea de mai sus a fost afișat notația sau simbolul nuclear pentru izotopul carbon-12.
Descrierea acestuia este la fel ca stabilirea caracteristicilor atomului de carbon prin excelență. Numărul său atomic 6 indică numărul de protoni din nucleul său. Numărul 12 este egal cu suma protonilor și neutronilor și, prin urmare, este masa atomică; care este proporțională cu masa nucleară.
Și, deși această notație nu o arată, există 6 electroni care contracarcă sarcina pozitivă a protonilor din nucleu. Din punctul de vedere al legăturilor chimice, patru dintre acești șase electroni sunt cei care stabilesc bazele vieții așa cum o cunoaștem noi..
Poveste
Cercetările lui Dalton (1810) au indicat că apa conținea un procent de oxigen de 87,7% și hidrogen de 12,5%. Dar, Dalton a subliniat că formula pentru apă a fost OH. Davy și Berzelius (1812) au corectat formula pentru apă la HDouăSAU.
Ulterior, Berzelius a găsit următoarea compoziție de apă: oxigen 88,8% și hidrogen 11,2%. El a considerat că greutatea atomică a hidrogenului este de 1 g, iar cea a oxigenului de 16 g.
Apoi, și-au dat seama că folosind greutatea atomică de 1 g pentru hidrogen, greutatea atomică a oxigenului ar fi de 15,9 g. Acest motiv, printre altele, a condus la stabilirea masei atomice de oxigen de 16 g ca standard de referință pentru masele atomice ale diferitelor elemente chimice..
Oxigenul a fost folosit ca standard de referință de la sfârșitul secolului al XIX-lea până în 1961, când s-a decis utilizarea carbonului ca standard de referință pentru stabilirea maselor atomice ale diferitelor elemente.
Înainte de 1959, IUPAP și IUPAC foloseau elementul oxigen pentru a defini molul după cum urmează: 1 mol este numărul de atomi de oxigen prezenți în 16 g.
Comentarii generale
Vorbeste despre 12C se referă la carbon în ansamblu; sau cel puțin 98% din esența sa, ceea ce este suficient pentru o astfel de aproximare. Acesta este motivul pentru care acest izotop nu are niciun folos în sine, în timp ce elementul ca atare și solidele pe care le integrează acoperă sute de aplicații..
Cu toate acestea, trebuie remarcat faptul că organismele vii au o preferință specială pentru acest izotop decât pentru 13C; adică procentul de 13C sau relația 12C /13C variază în funcție de ecosisteme, regiuni sau specii de animale.
Acest lucru se poate datora faptului că moleculele cu prea mulți atomi de carbon 13C, mai greu, împiedică sau afectează procesele metabolice și funcționarea celulelor corpului; chiar dacă procentul de 13C la ființele vii a fost puțin peste 1%.
De aceea 12C este izotopul carbonului responsabil pentru viață. Si 14C „contorul de timp” al rămășițelor sale, datorită degradării sale radioactive.
O altă utilitate indirectă a 12C este de a crea „contrast” pentru tehnica de spectroscopie prin rezonanță magnetică nucleară a 13C, cu care structura de carbon a compușilor organici poate fi elucidată (descoperită și construită).
Referințe
- Phillips, Basil. (08 iulie 2019). Care este cel mai comun izotop al carbonului? sciencing.com. Recuperat de pe: sciencing.com
- César Tomé López. (2019). Dintre greutățile atomice. Recuperat de pe: culturacientifica.com
- ElSevier. (2019). Carbon-12. ScienceDirect. Recuperat de pe: sciencedirect.com
- R. Nava. (s.f.). Notare nucleară. Recuperat de la: hyperphysics.phy-astr.gsu.edu
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.


Nimeni nu a comentat acest articol încă.