
Formula de încărcare formală, modul de calcul și exemple
taxă formală (CF) este unul care este atribuit unui atom al unei molecule sau al ionului, care permite explicarea structurilor și proprietăților sale chimice pe baza acestuia. Acest concept implică luarea în considerare a caracterului maxim al covalenței în legătura A-B; adică perechea de electroni este împărțită în mod egal între A și B.
Pentru a înțelege cele de mai sus, imaginea inferioară prezintă doi atomi legați: unul desemnat cu litera A și celălalt cu litera B. După cum se poate vedea, în interceptarea cercurilor se formează o legătură cu perechea „:”. În această moleculă heteronucleară, dacă A și B au electronegativități egale, perechea ":" rămâne echidistantă atât de A, cât și de B.
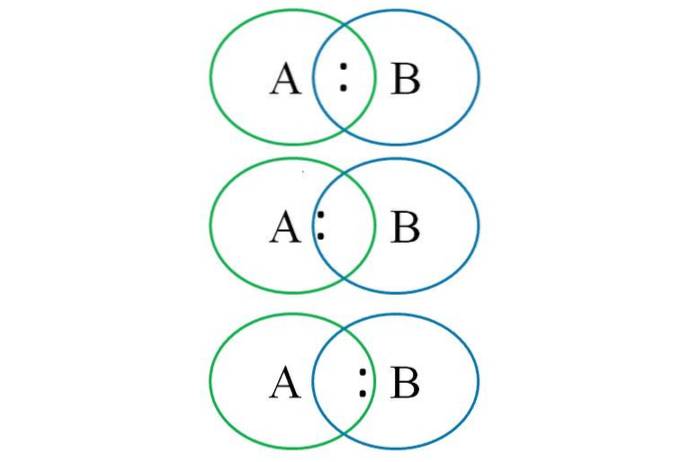
Cu toate acestea, deoarece doi atomi diferiți nu pot avea proprietăți identice, perechea „:” este atrasă de cea care este mai electronegativă. În acest caz, dacă A este mai electronegativ decât B, perechea ":" este mai aproape de A decât de B. Opusul apare atunci când B este mai electronegativ decât A, acum apropiindu-se de ":" la B.
Deci, pentru a atribui taxele formale atât A cât și B, este necesar să se ia în considerare primul caz (cel de deasupra imaginii). Dacă legătura pur covalentă A-B s-ar rupe, s-ar produce o ruptură omolitică, generând radicalii liberi A · și · B.
Indice articol
- 1 Beneficiile calitative ale angajării sarcinii formale
- 2 Formula și cum să o calculați
- 2.1 Variații ale calculului în funcție de structură
- 3 Exemple de calcule ale sarcinilor formale
- 3.1 BF4- (ion tetrafluoroborat)
- 3.2 BeH2 (hidrură de beriliu)
- 3,3 CO (monoxid de carbon)
- 3,4 NH4 + (ion amoniu), NH3 și NH2- (ion amidă)
- 4 Referințe
Avantajele calitative ale angajării sarcinii formale
Electronii nu sunt fixi, ca în exemplul anterior, ci se deplasează și se pierd prin atomii moleculei sau ionului. Dacă este o moleculă diatomică, se știe că perechea „:” trebuie împărțită sau rătăcită între ambii atomi; la fel se întâmplă și într-o moleculă de tip A-B-C, dar cu o complexitate mai mare.
Cu toate acestea, atunci când studiați un atom și presupuneți o covalență de sută la sută în legăturile sale, este mai ușor să stabiliți dacă câștigă sau pierde electroni din compus. Pentru a determina acest câștig sau pierdere, starea dvs. de bază sau gratuită trebuie comparată cu mediul dvs. electronic..
În acest fel, este posibil să atribuiți o sarcină pozitivă (+) dacă atomul pierde un electron sau o sarcină negativă (-) atunci când, dimpotrivă, câștigă un electron (semnele trebuie scrise în interiorul unui cerc).
Astfel, deși electronii nu pot fi localizați exact, aceste sarcini formale (+) și (-) de pe structuri se conformează în majoritatea cazurilor cu proprietățile chimice așteptate..
Adică, sarcina formală a unui atom este strâns legată de geometria moleculară a mediului său și de reactivitatea acestuia în interiorul compusului..
Formula și modul de calcul
Sunt atribuite în mod arbitrar taxe oficiale? Raspunsul este nu. Pentru aceasta, câștigul sau pierderea de electroni trebuie calculat presupunând legături pur covalente, iar acest lucru se realizează prin următoarea formulă:
CF = (numărul grupului atomului) - (numărul de legături pe care le formează) - (numărul de electroni nepartajați)
Dacă atomul are un CF cu o valoare de +1, i se atribuie o sarcină pozitivă (+); întrucât dacă aveți un CF cu o valoare de -1, atunci i se atribuie o sarcină negativă (-).
Pentru a calcula corect CF, trebuie urmați următorii pași:
- Localizați în ce grup se găsește atomul în tabelul periodic.
- Numărați numărul de legături pe care le formează cu vecinii săi: legăturile duble (=) valorează două și legăturile triple valorează trei (≡).
- În cele din urmă, numărați numărul de electroni nepartajați, care poate fi observat cu ușurință cu structurile Lewis.
Variații de calcul în funcție de structură
Având în vedere molecula liniară A-B-C-D, sarcinile formale pentru fiecare atom pot varia dacă structura, de exemplu, este acum scrisă ca: B-C-A-D, C-A-B-D, A-C-D-B etc. Acest lucru se datorează faptului că există atomi care, împărtășind mai mulți electroni (formând mai multe legături), dobândesc CF pozitiv sau negativ.
Deci, care dintre cele trei structuri moleculare posibile corespunde compusului ABCD? Răspunsul este: cel care are în general cele mai mici valori ale CF; la fel, cea care atribuie sarcini negative (-) atomilor cei mai electronegativi.
Dacă C și D sunt mai electronegative decât A și B, atunci împărtășind mai mulți electroni dobândesc în consecință sarcini pozitive formale (văzute dintr-o regulă mnemonică).
Astfel, cea mai stabilă structură și cea mai favorizată din punct de vedere energetic este C-A-B-D, întrucât atât C cât și B formează o singură legătură. Pe de altă parte, structura A-B-C-D și cele care au C sau B formând două legături (-C- sau -D-), sunt mai instabile.
Care dintre toate structurile este cea mai instabilă? A-C-D-B, deoarece nu numai C și D formează două legături, ci și sarcinile lor negative negative (-) sunt adiacente una cu cealaltă, destabilizând în continuare structura.
Exemple de calcule formale ale sarcinii
BF4- (ion tetrafluoroborat)
Atomul de bor este înconjurat de patru atomi de fluor. Deoarece B aparține grupului IIIA (13), îi lipsește electroni nepartajați și formează patru legături covalente, CF-ul său este (3-4-0 = -1). Pe de altă parte, pentru F, un element al grupei VIIA (17), CF-ul său este (7-6-1 = 0).
Pentru a determina încărcarea ionului sau a moleculei, este suficient să adăugați CF individual al atomilor care îl compun: (1 (-1) + 4 (0) = -1).
Cu toate acestea, CF pentru B nu are o semnificație reală; adică cea mai mare densitate de electroni nu se află pe el. În realitate, această densitate de electroni este distribuită către cei patru atomi ai lui F, un element mult mai electronegativ decât B.
BeHDouă (hidrură de beriliu)
Atomul de beriliu aparține grupului IIA (2), formează două legături și nu are, din nou, electroni nepartajați. Astfel, CF-urile pentru Be și H sunt:
CFFi= 2-2-0 = 0
CFH= 1-1-0 = 0
Încărcați-văDouă= 1 (0) + 2 (0) = 0
CO (monoxid de carbon)
Structura sa Lewis poate fi reprezentată ca: C≡O: (deși are alte structuri de rezonanță). Repetând calculul CF, de data aceasta pentru C (din grupa IVA) și O (din grupul VIA), avem:
CFC= 4-3-2 = -1
CFSAU= 6-3-2 = +1
Acesta este un exemplu în care taxele formale nu sunt conforme cu natura elementelor. O este mai electronegativ decât C și, prin urmare, nu ar trebui să aibă un pozitiv.
Celelalte structuri (C = O și (+)CO(-)), deși respectă atribuirea coerentă a sarcinilor, nu respectă regula octetului (C are mai puțin de opt electroni de valență).
NH4+ (ion amoniu), NH3 și NHDouă- (ion amidă)
cu cât are mai mulți electroni în comun, cu atât este mai pozitiv CF-ul său (chiar și ionul de amoniu, deoarece nu are disponibilitate de energie pentru a forma cinci legături).
Aplicând în mod egal calculele pentru N în ionul amoniu, amoniac și ion amidic, avem apoi:
CF = 5-4-0 = +1 (NH4+)
CF = 5-3-2 = 0 (NH3)
Și, în sfârșit:
CF = 5-2-4 = -1 (NHDouă-)
Adică în NHDouă- N are patru electroni nepartajați și îi împarte pe toți atunci când formează NH4+. CF pentru H este egal cu 0 și, prin urmare, calculul dvs. este salvat.
Referințe
- James. (2018). O abilitate cheie: Cum se calculează taxa formală. Adus pe 23 mai 2018, de pe: masterorganicchemistry.com
- Dr. Ian Hunt. Departamentul de chimie, Universitatea din Calgary. Taxe formale. Adus pe 23 mai 2018, de pe: chem.ucalgary.ca
- Taxe formale. [PDF]. Adus pe 23 mai 2018, de pe: chem.ucla.edu
- Jeff D. Cronk. Taxă formală. Adus pe 23 mai 2018, de pe: guweb2.gonzaga.edu
- Whitten, Davis, Peck și Stanley. Chimie. (Ed. A VIII-a). CENGAGE Learning, p. 268-270.
- Shiver & Atkins. (2008). Chimie anorganică. (Ediția a patra., P. 38). Mc Graw Hill.
- Monica Gonzalez. (10 august 2010). Taxă formală. Adus pe 23 mai 2018, de pe: quimica.laguia2000.com



Nimeni nu a comentat acest articol încă.