
Concept eficient de încărcare nucleară, modul de calculare și exemple
sarcină nucleară efectivă (Zef) este forța de atracție exercitată de nucleu asupra oricăruia dintre electroni după ce a fost redusă de efectele ecranării și penetrării. Dacă nu ar exista astfel de efecte, electronii ar simți forța atractivă a sarcinii nucleare reale Z.
În imaginea de mai jos avem modelul atomic Bohr pentru un atom fictiv. Nucleul său are o sarcină nucleară Z = + n, care atrage electronii care orbitează în jurul său (cercurile albastre). Se poate observa că doi electroni se află pe o orbită mai aproape de nucleu, în timp ce al treilea electron se află la o distanță mai mare de acesta..
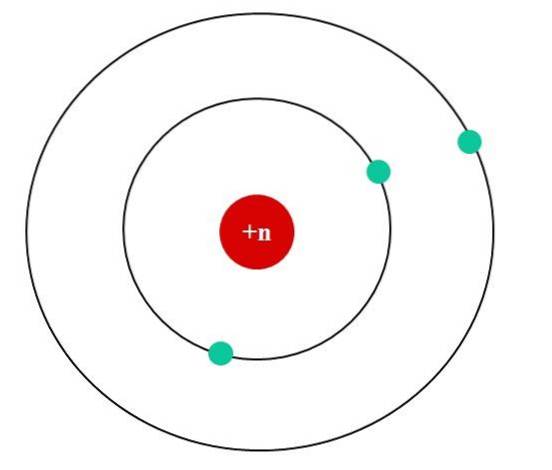
Al treilea electron orbitează simțind repulsiile electrostatice ale celorlalți doi electroni, astfel încât nucleul îl atrage cu mai puțină forță; adică interacțiunea nucleu-electron scade ca urmare a ecranării primilor doi electroni.
Deci, primii doi electroni simt forța atractivă a unei sarcini + n, dar al treilea experimentează o sarcină nucleară eficientă de + (n-2)..
Cu toate acestea, Zef a spus că ar fi valabil numai dacă distanțele (raza) la nucleul tuturor electronilor ar fi întotdeauna constante și definite, localizându-și sarcinile negative (-1).
Indice articol
- 1 Concept
- 1.1 Efecte de penetrare și ecranare
- 2 Cum se calculează?
- 2.1 Regula lui Slater
- 3 Exemple
- 3.1 Determinați Zef pentru electroni în orbitalul 2s2 din beriliu
- 3.2 Determinați Zef pentru electronii din orbitalul 3p3 al fosforului
- 4 Referințe
Concept
Protonii definesc nucleele elementelor chimice, iar electronii își definesc identitatea într-un set de caracteristici (grupurile din tabelul periodic)..
Protonii cresc sarcina nucleară Z cu o rată de n + 1, care este compensată prin adăugarea unui nou electron pentru stabilizarea atomului.
Pe măsură ce numărul de protoni crește, nucleul este „acoperit” de un nor dinamic de electroni, în care regiunile prin care circulă sunt definite de distribuțiile de probabilitate ale părților radiale și unghiulare ale funcțiilor undei (orbitalele).
Din această abordare, electronii nu orbitează într-o regiune definită a spațiului din jurul nucleului, ci mai degrabă, ca lamele unui ventilator care se rotește rapid, se estompează în formele orbitalilor cunoscuți s, p, d și f.
Din acest motiv, sarcina negativă -1 a unui electron este distribuită de acele regiuni pe care orbitalii le pătrund; cu cât efectul de penetrare este mai mare, cu atât este mai mare sarcina nucleară efectivă pe care electronul respectiv o va experimenta în orbital.
Efecte de penetrare și ecranare
Conform explicației de mai sus, electronii din cochiliile interioare nu contribuie cu o încărcare -1 la repulsia stabilizatoare a electronilor din cochiliile exterioare..
Cu toate acestea, acest miez (cochiliile umplute anterior de electroni) servește ca un „perete” care împiedică forța atractivă a nucleului să ajungă la electronii externi..
Acesta este cunoscut sub numele de efect de ecran sau efect de ecranare. De asemenea, nu toți electronii din cochiliile exterioare experimentează aceeași magnitudine a acestui efect; de exemplu, dacă ocupați un orbital care are un caracter penetrant ridicat (adică tranzitează foarte aproape de nucleu și de alți orbitali), atunci veți simți un Zef mai mare.
Ca urmare, o ordine de stabilitate energetică apare ca o funcție a acestor Zef pentru orbitalii: s Aceasta înseamnă că orbitalul 2p are o energie mai mare (mai puțin stabilizată de sarcina nucleului) decât orbitalul 2s.. Cu cât efectul de penetrare exercitat de orbital este mai slab, cu atât va fi mai puțin efectul său de protecție asupra restului electronilor externi. Orbitalele d și f prezintă multe găuri (noduri) în care nucleul atrage alți electroni. Presupunând că sarcinile negative sunt localizate, formula pentru calcularea Zef pentru orice electron este: Zef = Z - σ În această formulă σ este constanta de ecranare determinată de electronii miezului. Acest lucru se datorează faptului că, teoretic, electronii cei mai exteriori nu contribuie la protejarea electronilor interiori. Cu alte cuvinte, 1sDouă electron de scut 2s1, dar 2s1 nu protejează Z electroni 1sDouă. Dacă Z = 40, neglijând efectele menționate, atunci ultimul electron va experimenta un Zef egal cu 1 (40-39). Regula lui Slater este o bună aproximare a valorilor Zef pentru electronii din atom. Pentru a-l aplica, urmați pașii de mai jos: 1- Configurația electronică a atomului (sau ionului) ar trebui să fie scrisă după cum urmează: (1s) (2s 2p) (3s 3p) (3d) (4s 4p) (4d) (4f) ... 2- Electronii care se află în dreapta celui considerat nu contribuie la efectul de ecranare. 3- Electronii care se află în același grup (marcat cu paranteze) asigură 0,35 sarcina electronului, cu excepția cazului în care este grupul 1s, fiind în schimb 0,30. 4- Dacă electronul ocupă un orbital s sau p, atunci toți orbitalii n-1 contribuie cu 0,85 și toți orbitalii n-2 o unitate. 5- În cazul în care electronul ocupă un orbital d sau f, toți cei din stânga acestuia contribuie cu o unitate. Urmând modul de reprezentare Slater, configurația electronică a lui Be (Z = 4) este: (1sDouă) (2sDouă2 P0) Deoarece există doi electroni în orbital, unul dintre aceștia contribuie la protejarea celuilalt, iar orbitalul 1s este n-1 al orbitalului 2s. Apoi, dezvoltând suma algebrică, avem următoarele: (0,35) (1) + (0,85) (2) = 2,05 0.35 a venit de la electronul 2s, iar 0.85 de la cei doi electroni 1s. Acum, aplicând formula lui Zef: Zef = 4 - 2,05 = 1,95 Ce inseamna asta? Înseamnă că electronii din orbitalul 2sDouă experimentați o încărcare de +1,95 care îi atrage spre nucleu, mai degrabă decât încărcarea reală +4. Din nou, continuă ca în exemplul anterior: (1sDouă) (2sDouă2 P6) (3sDouă3p3) Acum suma algebrică este dezvoltată pentru a determina σ: (, 35) (4) + (0,85) (8) + (1) (2) = 10,2 Deci, Zef este diferența dintre σ și Z: Zef = 15-10,2 = 4,8 În concluzie, ultimii electroni de 3p3 au o încărcătură de trei ori mai mică decât cea reală. De asemenea, trebuie remarcat faptul că, conform acestei reguli, electronii 3sDouă experimentați același Zef, un rezultat care ar putea ridica îndoieli cu privire la aceasta. Cu toate acestea, există modificări ale regulii lui Slater care ajută la aproximarea valorilor calculate ale celor reale..Cum se calculează?
Regula lui Slater
Exemple
Determinați Zef pentru electronii din orbitalul 2sDouă în beriliu
Determinați Zef pentru electronii din orbitalul 3p3 de fosfor
Referințe



Nimeni nu a comentat acest articol încă.