
Structura cianurii de sodiu (NaCN), proprietăți, riscuri, utilizări

Cianura de sodiu este o sare anorganică formată dintr-un cation de sodiu Na+ și un anion cianură CN-. Formula sa chimică este NaCN. Cunoscut și sub numele de cianură de sodiu, este un solid cristalin alb. Este higroscopic, adică absoarbe apa din mediu, iar cristalele sale sunt cubice precum clorura de sodiu NaCl.
Când este dizolvat în apă, tinde să formeze cianură de hidrogen HCN. Soluțiile sale dizolvă ușor aurul și argintul. Această caracteristică îl face folosit pentru a extrage aurul și argintul din mineralele sale. Soluțiile utilizate în acest scop sunt reciclate, adică sunt refolosite de mai multe ori.

Cu toate acestea, o parte din cianură reușește să evadeze în anumite iazuri reziduale, ceea ce reprezintă un pericol pentru animale sălbatice și pentru oameni, deoarece cianura este foarte toxică și poate provoca moartea..
NaCN este utilizat în industria chimică ca intermediar pentru a prepara diferite tipuri de compuși, cum ar fi coloranți, produse chimice agricole și medicamente sau medicamente..
Cianura de sodiu este un compus foarte periculos, deoarece poate provoca moartea, deci trebuie tratată cu precauție extremă.
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Punctul de topire
- 3.4 Punctul de fierbere
- 3.5 Punct de aprindere
- 3.6 Densitate
- 3.7 Solubilitate
- 3.8 Constanta de disociere
- 3,9 pH
- 3.10 Proprietăți chimice
- 4 Riscuri
- 5 Obținerea
- 6 utilizări
- 6.1 La extragerea mineralelor de aur și argint. Consecințe
- 6.2 La producerea altor compuși chimici
- 6.3 În industria metalelor
- 6.4 În alte utilizări
- 6.5 Aplicații neutilizate, puse sub semnul întrebării sau foarte rare
- 7 Referințe
Structura
Cianura de sodiu este alcătuită dintr-un ion Na + și un ion CN-.
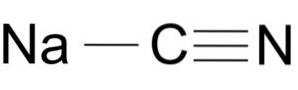
Ionul cianură are un atom de carbon C și un atom de azot N legate între ele printr-o legătură triplă..
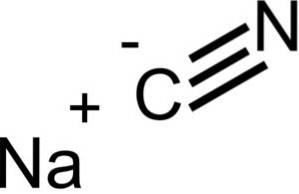
NaCN are aceeași structură cristalină ca NaCl, deci cristalele sale sunt cubice.
Nomenclatură
-Cianura de sodiu
-Cianura de sodiu
Proprietăți
Starea fizică
Solid cristalin alb higroscopic (absoarbe apa din mediu).
Greutate moleculară
49,007 g / mol
Punct de topire
563,7 ºC
Punct de fierbere
1496 ºC
Punct de aprindere
Nu este inflamabil. Dar dacă sunt expuse la foc, se produc cianură de hidrogen HCN și oxizi de azot..
Densitate
1.595 g / cm3 la 20 ° C
Solubilitate
Foarte solubil în apă: 48 g / 100 mL la 10 ° C, 82 g / 100 mL la 35 ° C. Ușor solubil în alcool
Constanta de disociere
Se hidrolizează într-o soluție apoasă generând HCN cianură de hidrogen. Constanta acestei hidrolize este Kh = 2,5 x 10-5.
pH
Soluțiile apoase de NaCN sunt puternic alcaline
Proprietăți chimice
Când este dizolvat în apă, se separă în ionii săi de Na+ și CN-. În soluție apoasă ionul cianură CN- ia un proton H+ de apă HDouăSau formând HCN și un ion OH-, deci soluția devine alcalină.
CN- + HDouăO → HCN + OH-
Din acest motiv, soluțiile sale apoase se descompun rapid atunci când sunt depozitate, formând cianură de hidrogen HCN..
Este coroziv față de aluminiu. Soluțiile sale dizolvă ușor aurul și argintul Ag în prezența aerului..
Este un agent chelator de la anionul cianură CN- se poate lega cu ușurință de alte metale, cum ar fi argintul, aurul, mercurul, zincul, cadmiul etc..
Are un miros slab de migdale amare.
Riscuri
Trebuie manipulat cu mare grijă. Este un compus foarte otrăvitor, inhibă procesele metabolice importante și duce la moarte prin ingestie, inhalare, absorbție prin piele sau contact cu ochii..
Dacă este inhalat, NaCN se dizolvă în mucoasa căilor respiratorii și trece în fluxul sanguin. Ionul cianură al NaCN are o puternică afinitate pentru fier în starea de oxidare de +3, adică cationul feric Fe3+.
Când cianura este absorbită, aceasta reacționează rapid cu Fe3+ a unei enzime importante a mitocondriilor celulelor (citocrom oxidaza), prevenind anumite procese ale respirației acestei.
Prin urmare, respirația celulară este inhibată sau încetinită și rezultă hipoxie citotoxică. Înseamnă că celulele și țesuturile nu pot folosi oxigen, în special celulele creierului și ale inimii.
În acest fel, apar deteriorări permanente sau letale ale corpului. Acest lucru poate apărea atât la oameni, cât și la animale..
Dacă este ingerat, provoacă congestie a vaselor de sânge și coroziune a mucoasei gastrice, în plus față de cele menționate anterior.

Nu este combustibil, dar în contact cu acizii, eliberează HCN, care este foarte inflamabil și toxic.
Dacă se topește cu nitriți sau clorați, poate exploda.
Obținerea
Se poate obține cu sodiu Na, amoniac NH3 și carbonul C. Sodiul reacționează cu amoniacul pentru a da amidă de sodiu NaNHDouă:
2 Na + 2 NH3 → 2 NaNHDouă + HDouă↑
Amida de sodiu este încălzită cu cărbune la 600 ° C și produce cianamidă de sodiu NaDouăNCN, care este apoi transformat în cianură de sodiu cu cărbune la 800 ° C:
2 NaNHDouă + C → 2 HDouă↑ + NaDouăNCN
N / ADouăNCN + C → 2 NaCN
O altă metodă este de a topi cianamida de calciu CaNCN și carbonul C cu carbonat de sodiu NaDouăCO3:
CaNCN + C + NaDouăCO3 → CaCO3 + 2 NaCN
Se poate prepara și prin trecerea azotului gaz NDouă printr-un amestec fierbinte de carbonat de sodiu NaDouăCO3 și pulbere de carbon C, folosind fierul Fe ca catalizator sau accelerator de reacție:
N / ADouăCO3 + 4 C + NDouă → 2 NaCN + 3 CO ↑
Aplicații
În extragerea mineralelor de aur și argint. Consecințe
Cianura de sodiu a fost folosită de mult timp pentru a extrage metalele aur și argint din minereurile lor..
Cianura utilizată în acest proces este reciclată, dar ceva scapă în iazul de gunoi împreună cu metalele grele nerecuperate.
Păsările, liliecii și alte animale care beau din aceste lagune de cianură au fost otrăvite.
Există înregistrări ale unui baraj din România care a izolat un iaz de deșeuri și a fost deteriorat de un eveniment meteorologic..
În consecință, tone de cianură au fost eliberate în râul Sasar și în sistemele acvifere din apropiere, cum ar fi râurile Lapus, Somes și Tisa, care se termină în Dunăre..
Acest lucru a provocat o cascadă de decese de animale sau, cu alte cuvinte, un dezastru ecologic..

La producerea altor compuși chimici
Cianura de sodiu NaCN este utilizată în sinteza diferitelor tipuri de compuși organici.
De exemplu, se prepară pigmenți și coloranți (inclusiv agenți de strălucire optici), compuși pentru utilizare în agricultură sau agrochimice și diverse produse farmaceutice..
De asemenea, este utilizat pentru a obține agenți de chelare sau de sechestrare pentru ioni metalici..
Compușii numiți nitrili sunt preparați cu cianură de sodiu NaCN, care atunci când sunt tratați cu soluție apoasă fierbinte acidă sau alcalină permite obținerea acizilor carboxilici.
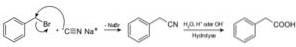
Permite prepararea acizilor grași cu grupări ciano, cianuri de metale grele și acid cianhidric sau cianură de hidrogen HCN.
În industria metalelor
NaCN este utilizat în soluții utilizate în galvanizarea sau galvanizarea metalelor (acoperirea metalelor cu altele), de exemplu zincul.
Este o componentă a oțelului întărit. De asemenea, servește la curățarea metalelor.
În alte utilizări
Cianura de sodiu este un intermediar în fabricarea nailonului.
Servește pentru separarea mineralelor prin flotația cu spumă.
Aplicații scoase din uz, puse în discuție sau foarte rare
NaCN a fost folosit pentru a ucide rozătoarele, cum ar fi iepurii și șobolanii și vizuinele lor și pentru a ucide cuiburile de termite.
În prezent este folosit ocazional pentru a elimina coioții, vulpile și câinii sălbatici. Utilizat sub formă de capsule ca doze unice sau multiple pe câmpuri, terenuri de vânătoare și păduri.
Datorită toxicității sale extreme, NaCN trebuie utilizat numai de către persoane instruite..
Această utilizare este considerată foarte periculoasă pentru oameni, dar sunt cei care încă o folosesc.

În agricultură era folosit anterior pentru fumigarea pomilor de citrice și a altor fructe. De asemenea, a fost folosit ca insecticid și miticid (eliminator de acarieni) pentru a fi aplicat după recoltare, pentru citrice ne-depozitate sau pentru fumigarea camioanelor utilizate pentru transportul acestora. De asemenea, a fost folosit pentru fumigarea navelor, vagoanelor și depozitelor..
Toate aceste utilizări au fost puse la îndoială din cauza toxicității ridicate a cianurii de sodiu. Din acest motiv, nu mai este utilizat sau doar foarte rar și în condiții foarte controlate..
Referințe
- S.U.A. Biblioteca Națională de Medicină. (2019). Cianura de sodiu. Recuperat de la pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Enciclopedia Tehnologiei Chimice. A patra editie. John Wiley & Sons.
- Hurst, S.E. și Martin, M.D. (2017). Toxicologie. Cianură. În farmacologie și terapie pentru stomatologie (ediția a șaptea). Recuperat de la sciencedirect.com.
- Coppock, R.W. și Dziwenka, M. (2015). Amenințări faunei sălbatice de către agenții de război chimic. În Manualul de toxicologie al agenților de război chimic (ediția a doua). Recuperat de la sciencedirect.com.
- Morrison, R.T. și Boyd, R.N. (2002). Chimie organica. Ediția a 6-a. Prentice-Hall.



Nimeni nu a comentat acest articol încă.