
Proprietăți, riscuri și utilizări ale acidului arsenios (H3AsO3)
acid arsenios este un compus anorganic cu formula H3AsO3. Structura sa este similară cu trihidroxiamina și poate fi rescrisă ca As (OH) 3. Este în formă apoasă și nu a fost posibil să-l izolăm într-o stare solidă pură. Structura sa este prezentată în figura 1.
Elaborarea As (OH) 3 implică o hidroliză lentă a trioxidului de arsen în apă. Suma bazei transformă acidul arsenos în ioni arsenit: [AsO (OH) 2] -, [AsO2 (OH)] 2- și [AsO3] 3-.
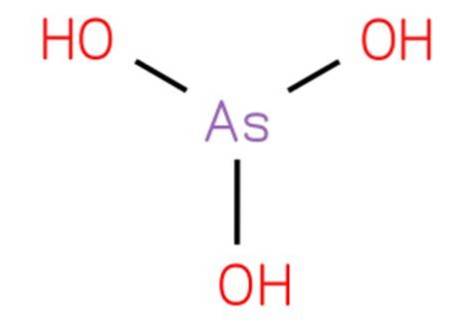
Este un acid slab. Reacțiile atribuite trioxidului de arsen apos se datorează acidului arsenic și bazelor sale conjugate.
Indice articol
- 1 Proprietățile fizice și chimice ale acidului arsenios
- 2 Reactivitate și pericole
- 2.1 În caz de contact cu ochii
- 2.2 În caz de contact cu pielea
- 2.3 În caz de ingestie
- 2.4 În caz de inhalare
- 3 utilizări
- 4 Referințe
Proprietățile fizice și chimice ale acidului arsenios
Acidul arsenos este o moleculă piramidală formată din trei grupări hidroxil atașate la arsenic. Spectrul 1H RMN al soluțiilor de acid arsenic constă dintr-un singur semnal în concordanță cu simetria ridicată a moleculei. Există doar în soluție apoasă.
Soluția menționată este incoloră și nu are aromă caracteristică. Este depozitat în containere de chihlimbar pentru a evita reacția cu radiațiile UV (Centrul Național pentru Informații despre Biotehnologie, 2017).

Greutatea sa moleculară este de 125,94 g / mol. Deși compusul nu a fost izolat, proprietățile sale au fost calculate folosind metode de calcul (© Royal Society of Chemistry, 2015) obținând că are un punct de topire de 271,52 ° C, un punct de fierbere de 626,14 ° C și o solubilitate în apă de 1 x 106 mg / l la 25 ° C.
Compusul are un pKa de 9,2 pentru reacție:
H3AsO3 ⇌ H2AsO3- + H+
Literatura de specialitate raportează că compusul are un caracter amfoteric, deși se disociază ca bază într-un grad mai mic decât se disociază ca acid, baza având un pKb de 14 pentru reacție:
As (OH) 3 ⇌ As (OH) 2+ + OH-
Acest lucru duce la formarea de specii cum ar fi sulfații de hidroxid de arsenic acid (As (OH) (HSO4) +, As (OH) 2 (HSO4)) în soluții concentrate de acid sulfuric sau la formarea sulfatului de acid arsenic (As (HSO4) ) 3) în soluții de fum sulfuric acid.
Acidul arsenic poate acționa ca un agent oxidant sau ca un agent reducător, rămânând ca arsenic elementar sau, respectiv, acid arsenic, în funcție de reacțiile pe jumătate:
H3AsO3 + 3H + + 3e- → As + 3 H2O (ξ0 = +0.240 V)
H3AsO3 + H2O → H3AsO4 + 2H + + 2e- (ξ0 = -0,560 V)
Acidul arsenios este un agent oxidant mai puternic decât omologul său fosfonic, dar un agent reducător mai slab decât acesta (Egon Wiberg, 2001).
Reactivitate și pericole
Acidul arsenos este un compus clasificat ca stabil, totuși este un reactiv toxic și coroziv.
Compusul prezintă un pericol neglijabil de incendiu și explozie atunci când este expus la căldură sau flacără. În acest caz, containerul trebuie mutat, dacă este posibil, pentru a evita respirația vaporilor sau a prafului..
Când este încălzit, compusul eliberează vapori toxici și corozivi de oxid de arsenic. Aparatele de respirat autonome și îmbrăcămintea de protecție trebuie purtate pentru a evita contactul în caz de incendiu.
Poate fi iritant pentru ochi, piele și mucoasă. Poate provoca sensibilizare. Intoxicația poate afecta sistemul nervos central, gastro-intestinal și cardiovascular, ficatul și rinichii. Compușii care conțin arsen sunt foarte toxici și cancerigeni.
În caz de contact cu ochii
Spălați cu multă apă timp de cel puțin 15 minute, ridicând ocazional pleoapele până când nu există dovezi de reziduuri chimice.
În caz de contact cu pielea
Spălați imediat cu multă apă și săpun timp de cel puțin 15 minute în timp ce îndepărtați îmbrăcămintea și pantofii contaminați. Arsurile sunt acoperite cu un bandaj steril uscat (sigur, nu strâns).
În caz de ingestie
Cantitățile mari de apă trebuie administrate victimei conștiente pentru a dilua acidul. Nu utilizați spălături gastrice și nu provocați vărsături. Personalul medical trebuie să mențină căile respiratorii și respirația.
În caz de inhalare
Respirația artificială trebuie administrată, dacă este necesar. Mutați victima într-un loc răcoros și păstrați-l cald și odihnit.
În toate cazurile, trebuie solicitată asistență medicală imediată (Fișa tehnică de securitate a soluției de acid arsenios, 2007).
Aplicații
Acidul arsenios este utilizat pentru a detecta cantități mici de iod sau compuși de iod. În lucrarea lui (Weegh, 1972) au fost studiate unele aspecte ale reacției cerice a acidului arsenic, acordând atenție proprietăților optice ale soluțiilor cerice..
Au fost de asemenea studiate efectele cinetice ale diferiților compuși, în special efectele ionilor de clorură și bromură și efectele cinetice ale clorurii sau bromurii în combinație cu iodura..
Acidul arsenic poate fi utilizat și ilicit pentru a provoca avorturi (Trend, 1858).
Acidul arsenos reacționează atunci când este încălzit pentru a forma trioxid de arsen (As2O3). Acest compus este, de asemenea, cunoscut sub numele de acid arsenic, deși nu este același compus. Structura trioxidului de arsen este prezentată în figura 3.
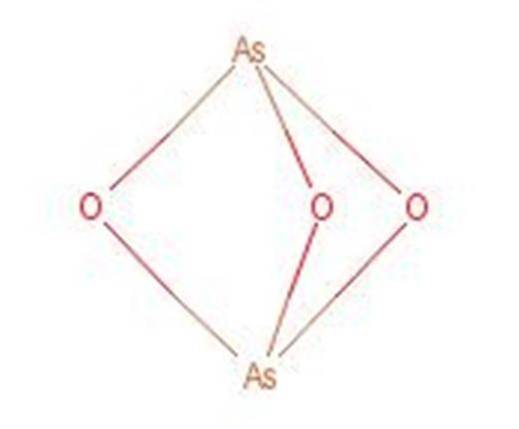
Figura 1: Structura trioxidului de arsen.
Acest compus, cunoscut și sub numele de Trisenox, este utilizat pentru a trata pacienții cu leucemie care nu au răspuns la alți agenți. Acest medicament este aprobat pentru utilizare de către Administrația SUA pentru Alimente și Medicamente (FDA) ca tratament pentru leucemie..
Nu este clar cum funcționează compusul. Poate provoca modificări morfologice și fragmentarea ADN-ului în celulele leucemiei promielocitare, provocând moartea celulelor și degradarea sau deteriorarea PML / RAR alfa (o proteină de fuziune) (Nurse's Drug Handbook 7th Ed, 2013).
Fiind otrăvitor pentru corpul uman, este unul dintre drogurile extrem de discutabile din domeniu. Trioxidul de arsen a fost folosit pentru prima dată ca medicament tradițional chinezesc numit Pi Shuang. Este folosit și astăzi pentru a trata pacienții cu cancer și alte afecțiuni de sănătate. (Revizuirea acidului arsenios, 2007-2016).
Referințe
- © Societatea Regală de Chimie. (2015). Acid arsenic. Recuperat de la chemspider.
- © Societatea Regală de Chimie. (2015). Trihidroxiamină. Recuperat de la chemspider.
- Revizuirea acidului arsenios. (2007-2016). Recuperat din medicalook.
- Acid arsenic. (2014, 28 iulie). Recuperat de pe ebi.ac.uk.
- Egon Wiberg, N. W. (2001). Chimie anorganică. Berlin: presa academică.
- Fișă tehnică de securitate Soluție de acid arsenios. (2007, 10 septembrie). Recuperat de pe t3db.ca.
- Centrul Național pentru Informații despre Biotehnologie. (2017, 4 martie). Baza de date compusă PubChem; CID = 545,. Adus de la PubChem.
- Manualul medicamentelor asistentei medicale Ediția a VII-a (2013). McGraw-Hill.
- Trend, H. G. (1858). Un caz în care acidul arsenios a fost folosit pentru a procura avortul. comunicarea originală a jurnalului medical britanic, 725-726.
- Weegh, W. H. (1972). Utilizarea reacției de acid arsenic ceric pentru determinarea unor cantități mici de iod sau compuși de iod. Clinica Chimica Acta Volumul 39, Ediția 2, 327-338.



Nimeni nu a comentat acest articol încă.