
Proprietăți, riscuri și utilizări ale acidului arsenic (H3AsO4)
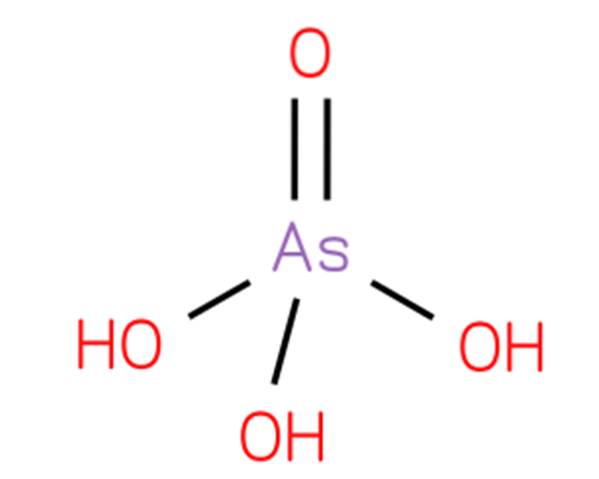
acid arsenic, hidrogen arseniat sau acid ortoarsenic, este un compus chimic a cărui formulă este H3AsO4. Un oxacid de arsen cuprinde o grupare oxo și trei grupări hidroxil atașate la un atom de arsenic central. Structura sa este prezentată în figura 1 (CHEBI: 18231 - acid arsenic, S.F.).
Structura sa este similară cu acidul fosforic (Royal Society of Chemistry, 2015) și poate fi rescrisă ca AsO (OH) 3. Acest compus este preparat prin tratarea trioxidului de arsen cu oxid nitric conform reacției: As2O3 + 2HNO3 + 2H2O → 2H3AsO4 + N2O3.
Soluția rezultată este răcită pentru a da cristale incolore ale hemihidratului H3AsO4 · ½H2O, deși dihidratul H3AsO4 · 2H2O apare atunci când cristalizarea are loc la temperaturi mai scăzute (Budavari, 1996).
Acidul arsenic este un compus extrem de toxic. Multe fișe cu date de siguranță recomandă evitarea contactului, dacă este posibil.
Indice articol
- 1 Proprietățile fizice și chimice ale acidului arsenic
- 2 Reactivitate și pericole
- 2.1 În caz de contact cu ochii
- 2.2 În caz de contact cu pielea
- 2.3 În caz de ingestie
- 2.4 În caz de inhalare
- 3 utilizări
- 4 Referințe
Proprietățile fizice și chimice ale acidului arsenic
Acidul arsenic este un solid higroscopic alb. Aspectul său este prezentat în figura 2.

În soluție apoasă, este un lichid higroscopic vâscos și transparent (Centrul Național pentru Informații despre Biotehnologie., 2017). Greutatea sa moleculară este de 141,94 g / mol, iar densitatea sa este de 2,5 g / ml. Punctul său de topire este de 35,5 ° C și punctul de fierbere este de 120 ° C unde se descompune.
Acidul arsenic este foarte solubil în apă, fiind capabil să dizolve 16,7 g la 100 ml, este de asemenea solubil în alcool. Compusul are un pKa de 2,19 pentru prima deprotonare și 6,94 și 11,5 pentru a doua și a treia deprotonare (Royal Society of Chemistry, 2015).
Acidul arsenic este un agent oxidant. Poate coroda oțelul și reacționează cu metalele galvanizate și alama.
Soluțiile de acid arsenic pot dezvolta arsină gazoasă foarte toxică (AsH3) la contactul cu metale active, cum ar fi zincul și aluminiul. Când este încălzit până la descompunere, produce vapori toxici de arsenic metalic.
Soluția este ușor acidă și un agent oxidant slab. Reacționează cu alcalii pentru a genera puțină căldură și precipita arseniați (ARSENIC ACID, LIQUID, 2016).
Reactivitate și pericole
Acidul arsenic este un compus stabil, necombustibil, care poate fi coroziv pentru metale. Compusul este foarte toxic și este un cancerigen confirmat pentru oameni.
Inhalarea, ingestia sau contactul cu pielea cu materialul pot provoca leziuni grave sau deces. Contactul cu substanța topită poate provoca arsuri severe la nivelul pielii și ochilor..
Evitați contactul cu pielea. Efectele contactului sau inhalării pot fi întârziate. Focul poate produce gaze iritante, corozive și / sau toxice. Apele uzate ale produsului pentru controlul sau diluarea incendiilor pot fi corozive și / sau toxice și pot provoca contaminare.
Simptomele otrăvirii cu acid arsenic sunt tuse și dificultăți de respirație dacă sunt inhalate. De asemenea, poate apărea roșeață pe piele, durere și senzație de arsură dacă intră în contact cu aceasta. În cele din urmă, simptomele în caz de ingestie sunt roșeață și durere la nivelul ochilor, dureri în gât, greață, vărsături, diaree și convulsii..
În caz de contact cu ochii
Acestea trebuie spălate cu multă apă timp de cel puțin 15 minute, ridicând sporadic pleoapele superioare și inferioare până când nu există dovezi de resturi chimice..
În caz de contact cu pielea
Spălați imediat cu multă apă și săpun timp de cel puțin 15 minute în timp ce îndepărtați îmbrăcămintea și pantofii contaminați. Acoperiți arsurile cu un bandaj steril uscat (sigur, nu strâns).
În caz de ingestie
Clătiți gura și asigurați victimei conștiente cantități mari de apă pentru a dilua acidul. În acest caz, trebuie utilizat spălarea gastrică și vărsăturile nu trebuie induse..
În caz de inhalare
Respirația artificială trebuie administrată, dacă este necesar. Metoda gură-la-gură nu trebuie utilizată dacă victima a ingerat sau a inhalat substanța..
Respirația artificială trebuie efectuată cu ajutorul unei măști de buzunar prevăzută cu o supapă unidirecțională sau alt dispozitiv medical respirator adecvat. Victima trebuie mutată într-un loc răcoros și menținută caldă și în repaus..
În toate cazurile, trebuie solicitată asistență medicală imediată (Institutul Național pentru Sănătate și Securitate în Muncă, 2015).
Acidul arsenic dăunează mediului. Substanța este foarte toxică pentru organismele acvatice. Trebuie luate măsuri pentru a limita eliberarea acestui compus chimic.
Aplicații
Acidul arsenic, având în vedere toxicitatea sa ridicată, are utilizări limitate. Cu toate acestea, acest compus a fost folosit ca pesticid și sterilizant pentru sol, deși este în prezent depășit (University of Hertfordshire, 2016).
De asemenea, a fost utilizat în prelucrarea lemnului și ca desicant în producția de bumbac din 1995. Pulverizarea plantelor face ca frunzele să se usuce rapid fără să cadă. Planta trebuie să fie suficient de uscată, astfel încât bolile de bumbac să poată ieși ușor.
Acidul arsenic este utilizat la producerea sticlei. Deși înregistrările consideră substanța ca un intermediar, această utilizare a acidului arsenic pare mai degrabă un „agent de procesare”, similar cu utilizarea trioxidului de diarsenic (As2O3) ca agent de finisare..
Acest compus rupe legăturile de oxigen dintre alte elemente prin reacția redox și produce oxigen gazos care ajută la eliminarea bulelor din sticlă (Position Paper of the European Glass Industries on, 2012).
Acidul arsanilic sau acidul 4-aminofenilarsonic este un derivat al acidului ortoarsenic. Se utilizează ca medicament veterinar antibacterian arsenic utilizat în prevenirea și tratamentul dizenteriei porcine (ARSENIC ACID, S.F.).
Arsenatul este sarea sau esterul acidului arsenic care are un ion negativ de AsO43-. Arsenatul seamănă cu fosfatul în multe feluri, deoarece arsenicul și fosforul apar în același grup (coloană) din tabelul periodic..
Arsenatul poate înlocui fosfatul anorganic în stadiul de glicoliză care produce 1,3-bisfosfoglicerat, producând în schimb 1-arsenic-3-fosfoglicerat. Această moleculă este instabilă și se hidrolizează rapid, formând următorul intermediar pe parcurs, 3-fosfogliceratul..
Prin urmare, glicoliza continuă, dar molecula ATP care ar fi generată din 1,3-bifosfoglicerat se pierde. Arsenatul este un decuplator al glicolizei, ceea ce explică toxicitatea acestuia.
Unele specii de bacterii își obțin energia prin oxidarea diferiților combustibili, reducând în același timp arsenatul pentru a forma arsenite. Enzimele implicate sunt cunoscute sub numele de arsenat reductaze..
În 2008, au fost descoperite bacterii care utilizează o versiune a fotosintezei cu arseniti ca donatori de electroni, producând arsenat (la fel ca fotosinteza obișnuită folosește apa ca donator de electroni, producând oxigen molecular).
Cercetătorii au presupus că, din punct de vedere istoric, aceste organisme fotosintetice au produs arsenatul care a permis bacteriilor care reduc reducerea arsenatului să prospere (Baza de date cu metabolici umani, 2017).
Referințe
- ACID ARSENIC. (S.F.). Recuperat de la chemicalland21.com.
- ACID ARSENIC, LICHID. (2016). Recuperat de la cameochemicals.noaa.gov.
- Budavari, S. (. (1996). Index Merck - O enciclopedie de produse chimice, medicamente și produse biologice. Stația Whitehouse, NJ: Merck and Co.
- CHEBI: 18231 - acid arsenic. (S.F.). Recuperat de pe ebi.ac.uk.
- Baza de date a metabolismului uman. (2017, 2 martie). Se afișează metabocard pentru Arsenat. Recuperat de la hmdb.ca.
- Centrul Național pentru Informații despre Biotehnologie ... (2017, 4 martie). Baza de date compusă PubChem; CID = 234,. Adus de la PubChem.
- Institutul Național pentru Securitate și Sănătate în Muncă. (2015, 22 iulie). ACID ARSENIC. Recuperat de pe cdc.gov.
- Document de poziție al industriilor europene de sticlă pe. (2012, 18 septembrie). Recuperat de la glassallianceeurope.
- Societatea Regală de Chimie. (2015). Acid arsenic. Recuperat de la chemspider.
- Societatea Regală de Chimie. (2015). Acid fosforic. Recuperat de la chemspider.
- Universitatea din Hertfordshire. (2016, 13 ianuarie). acid arsenic. Recuperat de la PPDB.



Nimeni nu a comentat acest articol încă.