
Proprietăți, riscuri și utilizări ale acidului bromic (HBrO3)
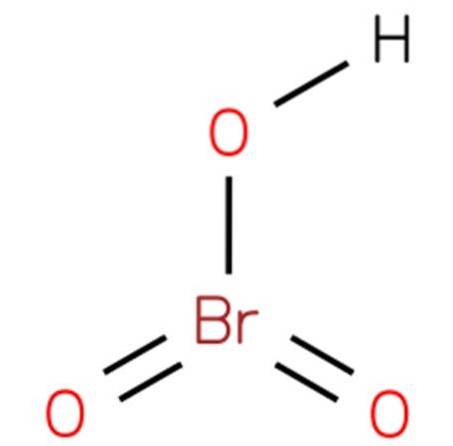
acid bromic, De asemenea, cunoscut sub numele de bromat de hidrogen sau acid bromic (V), este un compus chimic cu formula HBrO3. Este un oxacid de brom cu o structură analogă acidului cloric (EMBL-EBI, 2014). Compusul este un acid foarte puternic. Structura sa este prezentată în figura 1 (EMBL-EBI, 2008).
Pentru a prepara acidul bromic, un bromat solubil este de obicei dizolvat în apă și se adaugă o sare de bariu solubilă. Precipită bromatul de bariu slab solubil.
Bromatul de bariu poate fi apoi dizolvat în apă și acidulat cu acid sulfuric pentru a precipita sulfatul de bariu practic insolubil și a lăsa acidul bromic în urmă (vezi imaginea de mai sus):
2KBrO3 (aq) + BaCl2 (aq) -> Ba (BrO3) 2 (s) + 2KCl (aq)
Ba (BrO3) 2 (aq) + H2SO4 (aq) -> 2HBrO3 + BaSO4
Compusul poate fi produs și prin descompunerea pentaclorurii de brom în soluție alcalină conform reacției:
BrCl5 + 3 H2O → HBrO3 + 5 HCl
Acidul bromic este un agent oxidant puternic. Ionul bromat poate fi oxidat în continuare cu fluor elementar sau difluorură de xenon în prezența bazei, oxidare însoțită de mici explozii și tubul de teflon prins în foc (My Favorite Chemicals, S.F.).
Indice articol
- 1 Proprietățile fizice și chimice ale acidului bromic
- 2 Reactivitate și pericole
- 2.1 În caz de contact cu ochii
- 2.2 În caz de contact cu pielea
- 2.3 În caz de inhalare
- 3 utilizări
- 4 Referințe
Proprietățile fizice și chimice ale acidului bromic
Acidul bromic există doar în soluție incoloră (până la 50% g / v) care devine gălbuie în contact cu aerul (Centrul Național pentru Informații despre Biotehnologie., 2017). Aspectul său este prezentat în figura 2.

Compusul are o greutate moleculară de 128,91 g / mol și se descompune la 100 ° C și are un pKa de -2. Fiind un compus instabil, proprietățile sale fizico-chimice au fost obținute prin calcule de calcul..
Are un punct de topire de 206,04 ° C, un punct de fierbere de 517,26 ° C și o solubilitate în apă de 1 x 106 mg / l la 25 ° C (Royal Society of Chemistry, 2015).
Compusul este un agent oxidant puternic. Când este amestecat cu etanol sau eter, se descompune pentru a forma acid acetic într-o reacție exotermă. Este esențial pentru elaborarea sărurilor de bromat (BrO3-) care sunt preparate prin reacția carbonaților sau oxizilor metalici cu acidul bromic (Watts, 1870).
Reactivitate și pericole
Acidul bromic este un compus instabil care se descompune în brom elementar. Fiind un acid puternic, este extrem de periculos în caz de contact cu pielea (coroziv și iritant), în contact cu ochii (iritant) și în caz de ingestie. Foarte periculos și în caz de inhalare.
Supraexpunerea severă poate provoca leziuni pulmonare, sufocare, pierderea cunoștinței sau moarte. Expunerea prelungită poate provoca arsuri ale pielii și ulcerații. Supraexpunerea prin inhalare poate provoca iritații respiratorii..
Inflamația ochiului se caracterizează prin roșeață, udare și mâncărime. Inflamația pielii se caracterizează prin mâncărime, peeling, roșeață și ocazional vezicule.
Substanța este toxică pentru rinichi, plămâni și mucoase. Expunerea repetată sau prelungită la substanță poate provoca deteriorarea acestor organe..
În caz de contact cu ochii
Verificați dacă lentilele de contact sunt purtate și scoateți-le imediat. Ochii trebuie spălați cu apă curgătoare timp de cel puțin 15 minute, ținând pleoapele deschise. Se poate folosi apa rece. Unguentul pentru ochi nu trebuie utilizat.
În caz de contact cu pielea
Dacă substanța chimică intră în contact cu îmbrăcămintea, îndepărtați-o cât mai repede posibil, protejându-vă propriile mâini și corp. Așezați victima sub un duș de siguranță.
Dacă substanța chimică se acumulează pe pielea expusă a victimei, cum ar fi mâinile, pielea contaminată este spălată ușor și cu grijă cu apă curentă și săpun non-abraziv. Se poate folosi apa rece. Dacă iritația persistă, solicitați asistență medicală. Spălați hainele contaminate înainte de a le folosi din nou.
Dacă contactul cu pielea este sever, trebuie spălat cu un săpun dezinfectant și acoperiți pielea contaminată cu o cremă antibacteriană..
În caz de inhalare
Este recomandabil să lăsați victima să se odihnească într-o zonă bine ventilată. Dacă inhalarea este severă, victima trebuie evacuată într-o zonă sigură cât mai curând posibil. Slăbiți îmbrăcămintea strânsă, cum ar fi gulerul, cămașa sau cravata cămășii. Dacă victimei îi este greu să respire, trebuie administrat oxigen.
Dacă victima nu respiră, se efectuează resuscitarea gură la gură. Ținând cont întotdeauna că poate fi periculos pentru persoana care acordă ajutor să ofere resuscitare gură la gură atunci când materialul inhalat este toxic, infecțios sau coroziv..
În caz de înghițire, nu provocați vărsături. Slăbiți îmbrăcămintea strânsă, cum ar fi gulerele pentru cămăși, curele sau cravate. Dacă victima nu respiră, efectuați resuscitarea gură la gură.
În toate cazurile, solicitați asistență medicală imediată..
Aplicații
Acidul bromic este utilizat ca agent oxidant puternic în reacțiile de laborator. Este folosit pentru a produce compuși chimici, cum ar fi iodat, acid cloric, acid tetraihonic, printre altele..
Este, de asemenea, utilizat pentru producerea de bromați, cum ar fi fierul, plumbul, manganul și bromatul de mercur, printre altele..
Acidul bromic acționează ca un intermediar important în reacția Bélousov-Zhabotinsky (Morris, 2010). Această reacție este un exemplu de ceasuri chimice și ilustrează o reacție termodinamică de neechilibru.
Reacția de oscilație este catalizată de ceriu și este inerent legată de chimia oxizilor de brom HBrOx. Interesul crescând pentru sistemele chimice neliniare a oferit stimulente puternice pentru a studia chimia bromului..
În reacția Belousov-Zhabotinsky, compușii de brom implicați sunt acidul hipobromos HOBr, acidul bromos HOBrO și acidul bromic HBrO3 (3) (Rainer Glaser, 2013).
Aceste tipuri de reacții sunt importante pentru chimia teoretică. Acestea arată că reacțiile chimice nu trebuie să fie dominate de un comportament termodinamic de echilibru.
Referințe
- Acid bromic. (S.F.). Recuperat de la chemyq.com.
- EMBL-EBI. (2008, 16 mai). acid bromic. Recuperat de pe ebi.ac.uk.
- EMBL-EBI. (2014, 28 iulie). acid cloric. Recuperat de pe ebi.ac.uk.
- Morris, S. (2010, 23 ianuarie). Reacția Belousov Zhabotinsky 8 x viteza normală. Recuperat de pe youtubecom.
- Produsele mele chimice preferate. (S.F.). Recuperat de pe bromicacid.com.
- Centrul Național pentru Informații despre Biotehnologie. (2017, 11 martie). Baza de date compusă PubChem; CID = 24445 ,. Adus de la PubChem.
- Rainer Glaser, M. D. (2013). De ce aciditatea acidului bromic contează cu adevărat pentru modelele cinetice ale reacțiilor chimice oscilante Belousov-Zhabotinsky. Journal of Thermodynamics & Catalysis 4: 1.
- Societatea Regală de Chimie. (2015). Acid bromic. Recuperat de la chemspider.com.
- Watts, H. (1870). A Dictionary of Chemistry and Allied Branches of Other Sciences, Volume 1. London: longmans, green and co.



Nimeni nu a comentat acest articol încă.