
Proprietăți fizice și chimice ale acidului bromos (HBrO2)

acid bromos Este un compus anorganic cu formula HBrO2. Acidul menționat este unul dintre acizii de brom oxacid în care se găsește într-o stare de oxidare de 3+. Sărurile acestui compus sunt cunoscute sub numele de bromiți. Este un compus instabil care nu a putut fi izolat în laborator.
Această instabilitate, analogă cu acidul de iod, se datorează unei reacții de dismutație (sau disproporție) pentru a forma acid hipobrom și acid bromic după cum urmează: 2HBrODouă → HBrO + HBrO3.
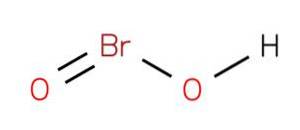
Acidul bromos poate acționa ca intermediar în diferite reacții la oxidarea hipobromiților (Ropp, 2013). Poate fi obținut prin mijloace chimice sau electrochimice în cazul în care hipobromitul este oxidat la ionul bromit, cum ar fi:
HBrO + HClO → HBrODouă + acid clorhidric
HBrO + HDouăO + 2e- → HBrODouă + HDouă
Indice articol
- 1 Proprietăți fizice și chimice
- 2 utilizări
- 2.1 Compuși alcalino-pământoși
- 2.2 Agent de reducere
- 2.3 Reacția Belousov-Zhabotinski
- 3 Referințe
Proprietati fizice si chimice
După cum s-a menționat mai sus, acidul bromos este un compus instabil care nu a fost izolat, astfel încât proprietățile sale fizice și chimice sunt obținute, cu unele excepții, teoretic prin calcule de calcul (Centrul Național pentru Informații despre Biotehnologie, 2017).
Compusul are o greutate moleculară de 112,91 g / mol, un punct de topire de 207,30 grade Celsius și un punct de fierbere de 522,29 grade Celsius. Solubilitatea sa în apă este estimată la 1 x 106 mg / L (Royal Society of Chemistry, 2015).
Nu există niciun risc înregistrat în manipularea acestui compus, cu toate acestea, sa constatat că este un acid slab..
Cinetica reacției de disproporționare a bromului (III), 2Br (III) → Br (1) + Br (V), a fost studiată în tampon fosfat, în domeniul pH-ului de 5,9-8,0, monitorizând absorbanța optică la 294 nm folosind oprit curgere.
Dependențele de [H+] și [Br (III)] erau de ordinul 1 și respectiv 2, unde nu a fost găsită nicio dependență de [Br-]. Reacția a fost, de asemenea, studiată în tampon acetat, în intervalul de pH 3,9 - 5,6.
În cadrul erorii experimentale, nu s-au găsit dovezi ale unei reacții directe între doi ioni BrO2. Acest studiu oferă constante de viteză 39,1 ± 2,6 M-1 pentru reacție:
HBrODouă + BrODouă→ HOBr + Br03-
Constante de viteză 800 ± 100 M-1 pentru reacție:
2HBr0Două → HOBr + Br03- + H+
Și un coeficient de echilibru de 3,7 ± 0,9 X 10-4 pentru reacție:
HBr02 ⇌ H + + BrODouă-
Obținerea unui pKa experimental de 3,43 la o putere ionică de 0,06 M și 25,0 ° C (R. B. Faria, 1994).
Aplicații
Compuși alcalino-pământoși
Acidul bromic sau bromitul de sodiu se utilizează pentru a produce bromit de beriliu pe baza reacției:
Fii (OH)Două + HBrODouă → Fii (OH) BrODouă + HDouăSAU
Bromiții sunt de culoare galbenă în stare solidă sau în soluții apoase. Acest compus este utilizat industrial ca agent de detartrare a amidonului oxidativ în rafinarea textilelor (Egon Wiberg, 2001).
Agent de reducere
Acidul bromic sau bromiții pot fi folosiți pentru a reduce ionul permanganat la manganat după cum urmează:
2MnO4- + BrODouă- + 2OH-→ BrO3- + 2MnO4Două- + HDouăSAU
Ce este convenabil pentru prepararea soluțiilor de mangan (IV).
Reacția Belousov-Zhabotinski
Acidul bromos acționează ca un intermediar important în reacția Belousov-Zhabotinski (Stanley, 2000), care este o demonstrație extrem de vizuală..
În această reacție, trei soluții sunt amestecate pentru a forma o culoare verde, care devine albastru, violet și roșu, apoi revine la verde și se repetă.
Cele trei soluții amestecate sunt după cum urmează: o soluție KBrO3 0,23 M, 0,31 M soluție de acid malonic cu 0,059 M KBr și 0,019 M ceriu (IV) soluție de azotat de amoniu și HDouăSW4 2,7M.
În timpul prezentării, o cantitate mică de indicator de feroină este introdusă în soluție. Ionii de mangan pot fi folosiți în locul ceriului. Reacția globală B-Z este oxidarea catalizată de ceriu a acidului malonic de către ioni bromat în acid sulfuric diluat, așa cum este prezentat în următoarea ecuație:
3CHDouă (CODouăH)Două + 4 BrO3- → 4 fr- + 9 CODouă + 6 oreDouăO (1)
Mecanismul acestei reacții implică două procese. Procesul A implică ioni și transferuri a doi electroni, în timp ce Procesul B implică radicali și transferuri ale unui electron..
Concentrația de ioni bromură determină care proces este dominant. Procesul A este dominant atunci când concentrația de ioni bromură este mare, în timp ce procesul B este dominant atunci când concentrația de ioni bromură este scăzută..
Procesul A este reducerea ionilor bromat de către ioni bromură în două transferuri de electroni. Poate fi reprezentat de această reacție netă:
BrO3- + 5Br- + 6H+ → 3BrDouă + 3HDouăSau (2)
Acest lucru se întâmplă atunci când soluțiile A și B. Sunt amestecate. Acest proces are loc prin următorii trei pași:
BrO3- + Fr- +2 ore+ → HBrODouă + HOBr (3)
HBrODouă + Fr- + H+ → 2 HOBr (4)
HOBr + fr- +H+ → frDouă + HDouăSau (5)
Bromul creat din reacția 5 reacționează cu acidul malonic pe măsură ce se încetinește, astfel cum este reprezentat de următoarea ecuație:
FrDouă + CHDouă (CODouăH)Două → BrCH (CODouăH)Două + Fr- + H (6)
Aceste reacții acționează pentru a reduce concentrația de ioni de bromură în soluție. Acest lucru permite procesului B să devină dominant. Reacția generală a procesului B este reprezentată de următoarea ecuație:
2BrO3- + 12H+ + 10 Ce3+ → frDouă + 10Ce4+6HDouăSAU (7)
Și constă din următorii pași:
BrO3 - + HBrODouă + H+ → 2BrODouă • + HDouăSAU (8)
BrODouă • + Ce3+ + H+ → HBrODouă + CE4+ (9)
2 HBrODouă → HOBr + BrO3 - + H+ (10)
2 HOBr → HBrODouă + Fr- + H+ (unsprezece)
HOBr + fr- + H+ → frDouă + HDouăO (12)
Elementele cheie ale acestei secvențe includ rezultatul net al ecuației 8 plus ecuația 9 de două ori, prezentat mai jos:
2Ce3+ + BrO3 - + HBrODouă + 3H+ → 2Ce4+ + HDouăO + 2HBrODouă (13)
Această secvență produce acid bromos în mod autocatalitic. Autocataliza este o caracteristică esențială a acestei reacții, dar nu continuă până când reactanții nu sunt epuizați, deoarece există o distrugere de ordinul doi al HBrO2, așa cum se vede în reacția 10.
Reacțiile 11 și 12 reprezintă disproporționarea acidului hiperbromos la acidul bromos și Br2. Ionii de ceriu (IV) și brom oxidează acidul malonic pentru a forma ioni de bromură. Acest lucru determină o creștere a concentrației de ioni de bromură, care reactivează procesul A.
Culorile din această reacție sunt formate în principal prin oxidarea și reducerea complexelor fier-ceriu..
Ferroina oferă două dintre culorile observate în această reacție: Pe măsură ce crește [Ce (IV)], acesta oxidează fierul din feroină din fier roșu (II) în fier albastru (III). Ceriul (III) este incolor, iar ceriul (IV) este galben. Combinația dintre ceriu (IV) și fier (III) face culoarea verde.
În condițiile potrivite, acest ciclu se va repeta de mai multe ori. Curățenia vaselor de sticlă este o problemă, deoarece oscilațiile sunt întrerupte de contaminarea cu ioni clorură (Horst Dieter Foersterling, 1993).
Referințe
- acid bromos. (2007, 28 octombrie). Adus de la ChEBI: ebi.ac.uk.
- Egon Wiberg, N. W. (2001). Chimie anorganică. londra-san diego: presa academică.
- Horst Dieter Foersterling, M. V. (1993). Acid bromos / ceriu (4+): reacție și disproporția HBrO2 măsurată în soluție de acid sulfuric la diferite acidități. Phys. Chem 97 (30), 7932-7938.
- acid iodat. (2013-2016). Adus de pe molbase.com.
- Centrul Național pentru Informații despre Biotehnologie. (2017, 4 martie). Baza de date compusă PubChem; CID = 165616.
- B. Faria, I. R. (1994). Cinetica disproporționării și pKa a acidului bromos. J. Phys. Chem. 98 (4), 1363-1367.
- Ropp, R. C. (2013). Enciclopedia compușilor alcalini ai pământului. Oxford: Elvesier.
- Societatea Regală de Chimie. (2015). Acid bromos. Adus de pe chemspider.com.
- Stanley, A. A. (2000, 4 decembrie). Demonstrație chimică anorganică avansată Rezumatul reacției oscilante.



Nimeni nu a comentat acest articol încă.