
Formula acidului butiric, proprietăți, riscuri și utilizări

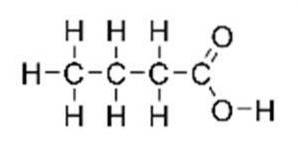
acid butiric, cunoscut și sub numele de acid n-butanoic (în sistemul IUPAC), este un acid carboxilic cu formula structurală CH3CH2CH2-COOH. Este clasificat ca un acid gras cu lanț scurt. Are un miros neplăcut, un gust acru și în același timp oarecum dulce (similar cu eterul). Structura sa este ilustrată în figura 1.
Se găsește în special în untul rânced, brânza parmezană, laptele crud, grăsimile animale, uleiurile vegetale și vărsăturile. Numele său este derivat din cuvântul grecesc βουτυρος, care înseamnă „unt” (colaboratori, 2016).
Acidul butiric se formează în colonul uman prin fermentarea bacteriană a carbohidraților (inclusiv fibrele dietetice) și presupune suprimarea cancerului colorectal.
Acidul butiric este un acid gras care apare sub formă de esteri în grăsimile animale și uleiurile vegetale. Interesant este că esterii cu acid molecular butiric cu greutate moleculară mică, cum ar fi butiratul de metil, au în general arome sau arome plăcute (centrul de inovație metabolomică, S.F.).
Indice articol
- 1 Proprietățile fizice și chimice ale acidului butiric
- 2 Reactivitate și pericole
- 3 Utilizări și beneficii pentru sănătate
- 4 Referințe
Proprietățile fizice și chimice ale acidului butiric
Acidul butiric este un lichid incolor cu un miros neplăcut și râncitor de unt. Are și un anumit gust de unt.
Are o greutate moleculară de 88,11 g / mol și o densitate de 0,9528 g / ml la temperatura camerei. Punctul său de topire este de -5,1 ° C, iar punctul de fierbere este de 163,75 ° C.
Compusul este solubil în apă, etanol și eter. Este ușor solubil în tetraclorură de carbon. Este un acid slab, ceea ce înseamnă că nu se disociază complet, pKa este de 4,82 (Centrul Național pentru Informații despre Biotehnologie, S.F.).
Un izomer, acid 2-metilpropanoic (izobutiric), (CH3) 2CHCO2H, se găsește atât în stare liberă, cât și în esterul său etilic în câteva uleiuri vegetale. Deși este comercial mai puțin important decât acidul butiric (Brown, 2011).
Acidul butiric poate reacționa cu agenții oxidanți. Reacțiile incandescente apar cu trioxid de crom peste 100 ° C. De asemenea, acestea sunt incompatibile cu bazele și agenții reducători. Poate ataca aluminiul și alte metale ușoare (ACID BUTIRIC, 2016).
Reactivitate și pericole
Acidul butiric este considerat un compus inflamabil. Incompatibil cu agenți oxidanți puternici, aluminiu și majoritatea celorlalte metale obișnuite, alcalii, agenți reducători (Royal Society of Chemistry, 2015).
Compusul este foarte periculos în caz de contact cu pielea (poate provoca arsuri), în caz de ingestie, contact cu ochii (iritant) și inhalare (poate provoca iritații severe ale căilor respiratorii).
Lichidul sau ceața din aerosoli pot produce leziuni ale țesuturilor, în special în membranele mucoase ale ochilor, gurii și ale căilor respiratorii..
Substanța este toxică pentru plămâni, sistemul nervos, mucoase. Expunerea repetată sau prelungită la substanță poate provoca leziuni ale acestor organe, precum și iritații ale căilor respiratorii, ducând la crize frecvente de infecție bronșică (Fișa tehnică de siguranță a acidului butiric, 2013).
În caz de contact cu ochii, victima trebuie verificată pentru lentile de contact și îndepărtată. Ochii victimei trebuie spălați cu apă sau soluție salină normală timp de 20 până la 30 de minute în timp ce sună simultan la spital.
În caz de contact cu pielea, zona afectată ar trebui să fie scufundată în apă în timp ce se îndepărtează și se izolează toate hainele contaminate. Toate zonele afectate ale pielii sunt spălate ușor cu apă și săpun. Trebuie obținută asistență medicală.
În caz de inhalare, lăsați zona contaminată într-un loc răcoros. Dacă apar simptome (cum ar fi respirație șuierătoare, tuse, dificultăți de respirație sau arsuri în gură, gât sau piept), sunați la un medic..
În caz de înghițire, vărsăturile nu trebuie induse. Dacă victima este conștientă și nu are convulsii, trebuie administrate 1 sau 2 pahare de apă pentru a dilua substanța chimică și a apela la un spital sau la un centru de control al otrăvurilor..
Dacă victima este convulsă sau inconștientă, nu dați nimic pe cale orală, asigurați-vă că căile respiratorii ale victimei sunt deschise și așezați-o pe partea lor cu capul mai jos decât corpul. Obțineți asistență medicală imediată.
Utilizări și beneficii pentru sănătate
Esterii cu acid molecular butiric cu greutate moleculară mică, cum ar fi butiratul de metil, au în general un miros și un gust plăcut. Din această cauză, găsesc utilizarea ca aditivi alimentari și de parfum..
Butiratul, baza conjugată a acidului butiric, poate fi găsit în mod natural în multe alimente. Poate fi adăugat, de asemenea, ca supliment sau agent aromatizant în altele.
Esterii acidului butiric sau butirații sunt utilizați pentru a produce arome artificiale și esențe de ulei vegetal. Butiratul de amil este un ingredient principal în uleiul de caise, în timp ce butiratul de metil poate fi găsit în uleiul de ananas..
Pe lângă faptul că este utilizat ca agent aromatizant, uleiul de ananas este, de asemenea, utilizat pentru a promova creșterea oaselor, pentru a vindeca operațiile dentare și pentru a trata răceala, durerile de gât și sinuzita acută, conform producătorului de produse naturale OCA Brasil (PULUGURTHA, 2015).
Bacteriile găsite în tractul gastro-intestinal pot produce cantități semnificative de butirat fermentant, fibre dietetice și carbohidrați nedigerabili. Consumul de alimente bogate în fibre, cum ar fi orz, fulgi de ovăz, orez brun și tărâțe, sunt o modalitate sănătoasă de a obține butiratul în corpul dumneavoastră..
Un studiu publicat în numărul din noiembrie 2010 al „Journal of Nutrition” indică faptul că o masă de cereale de seară bogată în carbohidrați nedigerabili poate crește concentrația de butirat plasmatic în dimineața următoare..
El adaugă că acesta ar putea fi mecanismul prin care cerealele integrale ajută la prevenirea diabetului și a bolilor de inimă..
Acidul butiric, ca butirat, se formează în colonul uman ca produs al fermentării fibrelor și acest lucru este sugerat ca un factor care explică de ce dietele bogate în fibre sunt protectoare în prevenirea cancerului de colon.
Au fost investigate mai multe ipoteze cu privire la posibilul mecanism al acestei relații, inclusiv dacă butiratul este important pentru menținerea expresiei fenotipice normale a celulelor epiteliale sau pentru îmbunătățirea eliminării celulelor deteriorate prin apoptoză..
Alte beneficii ale acidului butiric sau butiratului sunt:
- Ajută la scăderea în greutate.
- Ameliorează sindromul de colon iritat (Andrzej Załęski, 2013).
- Tratamentul bolii Crohn (Ax, S.F.).
- Combateți rezistența la insulină.
- Are efecte antiinflamatorii.
Referințe
- Andrzej Załęski, A. B. (2013). Acid butiric în sindromul intestinului iritabil. Przegla̜d Gastroenterologiczny, 350-353. Recuperat de la ncbi.nlm.nih.gov.
- Ax, J. (S.F.). Ce este acidul butiric? 6 Beneficii ale acidului butiric despre care trebuie să știți. Recuperat de la draxe: draxe.com.
- Brown, W. H. (2011, 2 decembrie). Acid butiric (CH3CH2CH2CO2H). Adus din enciclopedia britannica: recuperat de la britannica.com.
- ACID BUTIRIC. (2016). Recuperat din cameochemicals: cameochemicals.noaa.gov.
- colaboratori, N. W. (2016, 22 decembrie). Acid butiric. Adus din New World Encyclopedia: Recuperat de la newworldencyclopedia.org.
- Fișa tehnică de securitate a acidului butiric. (2013, 21 mai). Recuperat de la sciencelab: sciencelab.com.
- Centrul Național pentru Informații despre Biotehnologie. (S.F.). Baza de date compusă PubChem; CID = 264. Adus de la PubChem: ncbi.nlm.nih.gov.
- PULUGURTHA, S. (2015, 1 iunie). Ce alimente sunt bogate în butirat? Recuperat de la livestrong: livestrong.com.
- Societatea Regală de Chimie. (2015). Acid butanoic. Recuperat de la chemspider: chemspider.com.
- centrul de inovație metabolomică. (S.F.). Baza de date a metabolomului uman Afișând metabocard pentru acidul butiric. Adus de la hmdb.ca: hmdb.ca.



Nimeni nu a comentat acest articol încă.