
Proprietăți, riscuri și utilizări ale acidului fosforos (H3PO3)

acid fosforos, numit și acid ortofosforos, este un compus chimic cu formula H3PO3. Este unul dintre diferiții acizi oxigenați ai fosforului și structura sa este prezentată în figura 1 (EMBL-EBI, 2015).
Având în vedere formula compusului, acesta poate fi rescris ca HPO (OH)Două. Această specie există în echilibru cu un tautomer minor P (OH)3 (Figura 2).

Recomandările IUPAC, 2005 sunt că acesta din urmă se numește acid fosforos, în timp ce forma dihidroxi se numește acid fosfonic. Numai compușii reduși ai fosforului sunt compuși cu un „urs”..

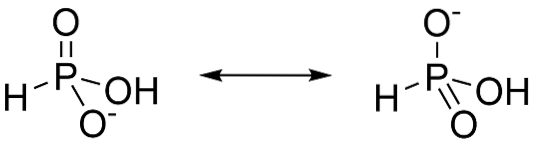
Acidul fosforos este un acid diprotic, ceea ce înseamnă că are doar capacitatea de a renunța la doi protoni. Acest lucru se datorează faptului că tautomerul majoritar este H3PO3. Când această formă pierde un proton, rezonanța stabilizează anionii formați, așa cum se arată în figura 3.
Tautomerul P (OH) 3 (Figura 4) nu are avantajul stabilizării rezonanței. Acest lucru face îndepărtarea celui de-al treilea proton mult mai dificil (De ce este acidul fosforic diprotic și nu triprotic?, 2016).

Acid fosforic (H3PO3) formează săruri numite fosfiți, care sunt folosiți ca agenți reducători (Britannica, 1998). Se prepară prin dizolvarea hexoxidului tetrafosforic (P4SAU6) conform ecuației:
P4SAU6 + 6 oreDouăO → 4 HPO (OH)Două
Acid fosforos pur, H3PO3, cel mai bine preparat prin hidroliza triclorurii de fosfor, PCl3.
PCl3 + 3HDouăO → HPO (OH)Două + 3HCI
Soluția rezultată este încălzită pentru a îndepărta HCl, iar apa rămasă este evaporată până când apare 3PO3 incolor cristalin la răcire. Acidul poate fi obținut și prin acțiunea apei asupra PBr3 sau PI3 (Zumdahl, 2018).
Indice articol
- 1 Proprietăți fizice și chimice
- 2 Reactivitate și pericole
- 2.1 Reactivitate
- 2.2 Pericole
- 2.3 Acțiune în caz de avarie
- 3 utilizări
- 4 Referințe
Proprietati fizice si chimice
Acidul fosforos este cristale tetraedrice higroscopice albe sau galbene cu o aromă asemănătoare usturoiului (Centrul Național pentru Informații despre Biotehnologie, 2017).

H3PO3 are o greutate moleculară de 82,0 g / mol și o densitate de 1,651 g / ml. Compusul are un punct de topire de 73 ° C și se descompune peste 200 ° C. Acidul fosforos este solubil în apă, fiind capabil să dizolve 310 grame la 100 ml din acest solvent. De asemenea, este solubil în etanol.
În plus, este un acid puternic cu un pKa între 1,3 și 1,6 (Royal Society of Chemistry, 2015).
Încălzirea acidului fosforic la aproximativ 200 ° C face ca acesta să fie disproporționat în acid fosforic și fosfină (PH3). Fosfina, un gaz care în mod normal se aprinde spontan în aer.
4H3PO3 + căldură → PH3 + 3H3PO4
Reactivitate și pericole
Reactivitate
- Acidul fosforos nu este un compus stabil.
- Absoarbe oxigenul din aer pentru a forma acid fosforic.
- Formează depuneri galbene într-o soluție apoasă care sunt inflamabile spontan la uscare.
- Reacționează exoterm cu baze chimice (de exemplu: amine și hidroxizi anorganici) pentru a forma săruri.
- Aceste reacții pot genera cantități periculoase de căldură în spații mici..
- Dizolvarea în apă sau diluarea unei soluții concentrate cu apă suplimentară poate genera căldură semnificativă.
- Reacționează în prezența umezelii cu metale active, inclusiv metale structurale precum aluminiu și fier, pentru a elibera hidrogen, un gaz inflamabil.
- Poate iniția polimerizarea anumitor alchene. Reacționează cu compușii cianurii pentru a elibera hidrogen cianură gazoasă.
- Poate genera gaze inflamabile și / sau toxice în contact cu ditiocarbamați, izocianați, mercaptani, nitriți, nitrili, sulfuri și agenți reductori puternici.
- Reacții suplimentare de generare a gazelor apar cu sulfiți, nitriți, tiosulfati (pentru a da H2S și SO3), ditioniți (pentru a da SO2) și carbonați (pentru a da CO2) (ACID FOSFORIC, 2016).
Pericole
- Compusul este coroziv pentru ochi și piele.
- Contactul cu ochii poate duce la deteriorarea corneei sau la orbire..
- Contactul cu pielea poate provoca inflamații și vezicule.
- Inhalarea prafului va produce iritarea tractului gastro-intestinal sau respirator, caracterizată prin arsură, strănut și tuse..
- Supraexpunerea severă poate provoca leziuni pulmonare, sufocare, pierderea cunoștinței sau deces (Fișa tehnică de securitate Acid fosforos, 2013).
Acțiune în caz de avarie
- Asigurarea faptului că personalul medical este conștient de materialele implicate și ia măsuri de precauție pentru a se proteja.
- Victima ar trebui să fie mutată într-un loc răcoros și să fie chemat serviciul medical de urgență.
- Respirația artificială trebuie administrată dacă victima nu respiră.
- Metoda gură-la-gură nu trebuie utilizată dacă victima a ingerat sau a inhalat substanța..
- Respirația artificială se efectuează cu ajutorul unei măști de buzunar prevăzută cu o supapă unidirecțională sau alt dispozitiv medical respirator adecvat.
- Oxigenul trebuie administrat dacă respirația este dificilă.
- Îmbrăcămintea și încălțămintea contaminate trebuie îndepărtate și izolate.
- În caz de contact cu substanța, clătiți imediat pielea sau ochii cu apă curentă timp de cel puțin 20 de minute..
- Pentru mai puțin contact cu pielea, evitați răspândirea materialului pe pielea neafectată..
- Mențineți victima calmă și caldă.
- Efectele expunerii (inhalare, ingestie sau contact cu pielea) la substanță pot fi întârziate.
Aplicații
Cea mai importantă utilizare a acidului fosforos este producția de fosfiți care sunt utilizați în tratarea apei. Acidul fosforic este, de asemenea, utilizat pentru prepararea sărurilor de fosfit, cum ar fi fosfitul de potasiu..
S-a demonstrat că fosfiții sunt eficienți în combaterea diferitelor boli ale plantelor.
În special, tratamentul prin injecție de trunchi sau foliar care conține săruri de acid fosforos este indicat ca răspuns la infecțiile de către agenții patogeni ai plantelor de tip fitofteră și pythium (cauzează descompunerea rădăcinii).
Acidul fosforos și fosfiții sunt folosiți ca agenți reducători în analiza chimică. O nouă sinteză convenabilă și scalabilă a acizilor fenilacetici, prin reducerea catalizată de iodură a acizilor mandelici, se bazează pe generarea in situ de acid hidroiodic din iodură de sodiu catalitică. Pentru aceasta, acidul fosforic este utilizat ca reductor stoichiometric (Jacqueline E. Milne, 2011).
Se utilizează ca ingredient pentru producerea aditivilor utilizați în industria clorurii de polivinil (acid fosforos (CAS RN 10294-56-1), 2017). De asemenea, esterii acidului fosforos sunt utilizați în diferite reacții de sinteză organică (Blazewska, 2009).
Referințe
- Blazewska, K. (2009). Science of Synthesis: Houben-Weyl Methods of Molecular Transformations Vol 42. New York: Thieme.
- (1998, 20 iulie). Acid fosforos (H3PO3). Recuperat de la Encyclopædia Britannica: britannica.com.
- EMBL-EBI. (2015, 20 iulie). acid fosfonic. Recuperat de pe ebi.ac.uk: ebi.ac.uk.
- Jacqueline E. Milne, T. S. (2011). Reduceri catalizate cu iodură: dezvoltarea unei sinteze de acizi fenilacetici. Org. Chem. 76, 9519-9524. organic-chimistry.org.
- Fișă tehnică de securitate a acidului fosforos. (2013, 21 mai). Recuperat de la sciencelab: sciencelab.com.
- Centrul Național pentru Informații despre Biotehnologie. (2017, 11 martie). Baza de date compusă PubChem; CID = 107909. Adus de la PubChem: ncbi.nlm.nih.gov.
- Acid fosforos (CAS RN 10294-56-1). (2017, 15 martie). Recuperat de la gov.uk/trade-tariff:gov.uk.
- ACID FOSFORIC. (2016). Recuperat din cameochemicals: cameochemicals.noaa.gov.
- Societatea Regală de Chimie. (2015). ACID FOSFORIC. Recuperat de la chemspider: chemspider.com.
- De ce acidul fosforic este diprotic și nu triprotic? (2016, 11 martie). Recuperat din chemistry.stackexchange.
- Zumdahl, S. S. (2018, 15 august). Oxiacid. Recuperat de la britannica.com.



Nimeni nu a comentat acest articol încă.