
Structura acidului fosforic (H3PO4), proprietăți, utilizări

acid fosforic Este un oxoacid de fosfor care are formula chimică H3PO4. Se compune dintr-un acid mineral în care trei protoni acizi sunt legați de anionul fosfat (PO43-). Deși nu este considerat un acid puternic, utilizarea necorespunzătoare a acestuia poate prezenta un risc pentru sănătate.
Poate fi găsit în două stări: ca un solid sub formă de cristale ortorombice groase sau ca un lichid cristalin cu aspect siropos. Cea mai comună prezentare comercială are o concentrație de 85% g / g și o densitate de 1,685 g / cm3. Această densitate provine din mâna concentrării.
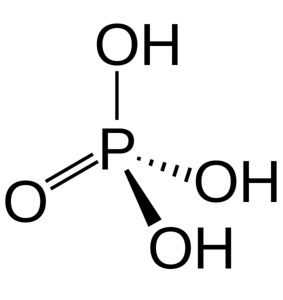
Cele trei grupuri OH sunt responsabile pentru donarea de hidrogeni acizi. Datorită prezenței acestora în structura sa, acesta poate reacționa cu diferiți hidroxizi originând diverse săruri.
În cazul hidroxidului de sodiu, acesta poate forma trei: fosfat de sodiu monobazic (NaHDouăPO4), fosfat de sodiu dibazic (NaDouăHPO4) și fosfat de sodiu tribazic (Na3PO4).
Cu toate acestea, în funcție de baza care este utilizată pentru neutralizarea acesteia sau de cationii care sunt foarte aproape de ea, poate forma alte săruri de fosfat. Printre acestea se numără: fosfatul de calciu (Ca3(PO4)Două), fosfat de litiu (Li3PO4), fosfat feric (FePO4), si altii. Fiecare cu diferitele sale grade de protonație a anionului fosfat.
Pe de altă parte, acidul fosforic poate „sechestra” cationii divalenți, cum ar fi FeDouă+, CuDouă+, ACDouă+ și MgDouă+. La temperaturi ridicate, acesta poate reacționa cu el însuși cu pierderea unei molecule de HDouăSau, formând dimeri, trimeri și polimeri ai acizilor fosforici.
Acest tip de reacție face ca acest compus să poată stabili un număr mare de structuri cu schelete de fosfor și oxigen, din care poate fi obținută și o gamă largă de săruri cunoscute sub numele de polifosfați..
În ceea ce privește descoperirea sa, a fost sintetizată în 1694 de Robert Boyle, dizolvând PDouăSAU5 (pentoxid de fosfor) în apă. Este unul dintre cei mai utili acizi minerali, funcția sa de îngrășământ fiind cea mai importantă. Fosforul, alături de potasiu și azot, constituie cei trei nutrienți principali ai plantei.
Indice articol
- 1 Structura chimică
- 1.1 Acid difosforic (H4P2O7)
- 1.2 Acizi polifosforici
- 1.3 Acizi polifosforici ciclici
- 2 Nomenclatură
- 2.1 Ortho
- 2.2 Pyro
- 2.3 Scop
- 3 Proprietăți
- 3.1 Formula moleculară
- 3.2 Greutate moleculară
- 3.3 Aspect fizic
- 3.4 Puncte de fierbere și topire
- 3.5 Solubilitatea în apă
- 3.6 Densitate
- 3.7 Densitatea vaporilor
- 3.8 Aprindere automată
- 3.9 Vâscozitate
- 3.10 Aciditate
- 3.11 Descompunerea
- 3.12 Corozivitate
- 3.13 Polimerizare
- 4 utilizări
- 4.1 Săruri de fosfat și utilizări generale
- 4.2 Industrial
- 4.3 Dental
- 4.4 Cosmetice
- 5 Formarea acidului fosforic
- 6 Riscuri
- 7 Referințe
Structura chimică
Acidul fosforic este format dintr-o legătură P = O și trei P-OH, unde aceștia din urmă sunt purtătorii hidrogenilor acizi eliberați într-un mediu de dizolvare. Cu atomul de fosfor în centru, oxigenii desenează un fel de tetraedru molecular.
În acest fel, acidul fosforic poate fi vizualizat ca un tetraedru. Din această perspectivă, tetraedrul menționat (pe unități de H3PO4) interacționează între ele prin legături de hidrogen; adică vârfurile sale sunt aproape apropiate.
Aceste interacțiuni intermoleculare permit acidului fosforic să cristalizeze în două solide: anhidru și hemihidrat (H3PO41 / 2HDouăO), ambele cu sisteme de cristale monoclinice. Forma sa anhidră poate fi descrisă și prin formula: 3HDouăO · PDouăSAU5, care este egal cu un pentoxid de fosfor trihidratat.
Tetraedrele pot deveni chiar legate covalent, dar pentru aceasta una dintre unitățile lor trebuie să elimine o moleculă de apă prin deshidratare. Acest lucru se întâmplă atunci când H3PO4 este supus încălzirii și, în consecință, generează formarea de acizi polifosforici (PA).
Acid difosforic (H4PDouăSAU7)
Cel mai simplu dintre toate PA este acidul difosforic (H4PDouăSAU7), cunoscut și sub numele de acid pirofosforic. Ecuația chimică a formării sale este următoarea:
2H3PO4 <=> H4PDouăSAU7 + HDouăSAU
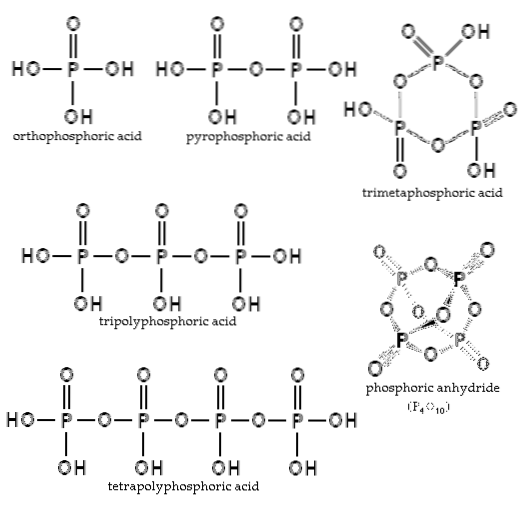
Echilibrul depinde de cantitatea de apă și de temperatură. Care este structura sa? În imaginea secțiunii, structurile acidului ortofosforic și ale acidului pirofosforic sunt ilustrate în colțul din stânga sus..
Două unități sunt unite covalent atunci când o moleculă de apă este eliminată, formând o punte de oxigen P-O-P între ele. Acum nu mai sunt trei hidrogeni acizi, ci patru (patru grupe -OH). Din această cauză, H4PDouăSAU7 are patru constante de ionizare kla.
Acizi polifosforici
Deshidratarea poate continua cu acidul pirofosforic dacă încălzirea continuă. De ce? Deoarece la fiecare capăt al moleculei sale există o grupare OH care poate fi îndepărtată ca moleculă de apă, promovând astfel creșterea ulterioară a scheletului P-O-P-O-P ...
Exemple de acești acizi sunt acizii tripolifosforici și tetrapolifosforici (ambii ilustrați în imagine). Se poate vedea cum coloana vertebrală P-O-P se prelungește într-un fel de lanț format din tetraedre.
Acești compuși pot fi reprezentați prin formula HO (PODouăOH)XH, unde HO este stânga extremă care poate fi deshidratată. PODouăOH este coloana vertebrală a fosforului cu legăturile P = O și OH; și x sunt unitățile sau moleculele de acizi fosforici necesare pentru a obține lanțul menționat.
Când acești compuși sunt complet neutralizați cu o bază, se creează așa-numiții polifosfați. În funcție de cationii care le înconjoară, formează o mare varietate de săruri polifosfat.
Pe de altă parte, dacă reacționează cu alcooli ROH, hidrogenii coloanei vertebrale sunt înlocuiți cu substituenții R-alchil. Astfel, apar esterii fosfaților (sau polifosfații): RO (PODouăSAU)XR. Este suficient să înlocuiți H cu R în toate structurile imaginii secțiunii pentru a le obține.
Acizi polifosforici ciclici
Lanțurile P-O-P se pot închide chiar pe un inel sau ciclu fosforic. Cel mai simplu dintre acest tip de compus este acidul trimetafosforic (colțul din dreapta sus al imaginii). Astfel, AP-urile pot fi liniare, ciclice; sau dacă structurile lor prezintă ambele tipuri, ramificate.
Nomenclatură
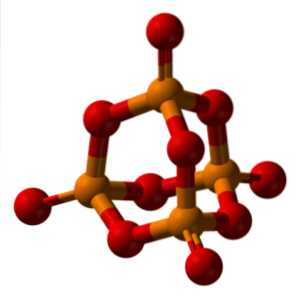
Nomenclatura acidului fosforic este dictată de IUPAC și cum sunt denumite sărurile ternare ale acizilor oxo.
Pentru că în H3PO4 atomul P are valența +5, cea mai mare valoare, acidului său i se atribuie sufixul -ico prefixului fosfor-.
Orto
Cu toate acestea, acidul fosforic este denumit și acid ortofosforic. De ce? Deoarece cuvântul „orto” este grecesc și înseamnă „adevărat”; care s-ar traduce în „forma adevărată” sau „mai hidratată” a aceleiași.
Când anhidrul fosforic este hidratat cu un exces de apă (P4SAU10, „capacul” de fosfor din imaginea de mai sus) este produs H3PO4 (3HDouăO · PDouăSAU5). Astfel, prefixul orto este atribuit acelor acizi formați cu apă abundentă.
Pyro
Prefixul piro se referă la orice compus originar după aplicarea căldurii, deoarece acidul difosforic apare din deshidratarea termică a acidului fosforic. Prin urmare, se numește acid pirofosforic (2HDouăO · PDouăSAU5).
Poartă
Prefixul meta, care este și un cuvânt grecesc, înseamnă „după”. Se adaugă acelor substanțe a căror formulă a eliminat o moleculă, în acest caz, a apei:
H3PO4 => HPO3 + HDouăSAU
Rețineți că de data aceasta adăugarea a două unități fosforice nu are loc pentru a forma acid difosforic, ci în schimb se obține acid metafosforic (despre care nu există dovezi ale existenței sale).
De asemenea, este important să rețineți că acest acid poate fi descris ca HDouăO · PDouăSAU5 (similar cu hemidratul, înmulțind HPO3 Pentru 2). Prefixul meta vine perfect în concordanță cu PA ciclic, deoarece dacă acidul trifosforic se deshidratează, dar nu adaugă o altă unitate H3PO4 pentru a deveni acid tetrafosforic, atunci trebuie să formeze un inel.
Și acest lucru este la fel cu alți acizi polimetafosforici, deși IUPAC recomandă numirea lor de compuși ciclici ai PA-urilor corespunzătoare..
Proprietăți
Formulă moleculară
H3PO4
Greutate moleculară
97,994 g / mol
Aspectul fizic
În forma sa solidă prezintă cristale ortorombice, higroscopice și transparente. Sub formă lichidă este cristalină cu aspect de sirop vâscos..
Este disponibil comercial în soluție apoasă cu o concentrație de 85% greutate / greutate. În toate aceste prezentări îi lipsește mirosul.
Puncte de fierbere și topire
158º C (316º F la 760 mmHg).
108º F (42.2º C).
Solubilitatea apei
548 g / 100 g HDouăSau la 20 ° C; 369,4 g / 100 ml la 0,5 ° C; 446 g / 100m la 14,95º C.
Densitate
1.892 g / cm3 (solid); 1,841 g / cm3 (Soluție 100%); 1,685 g / cm3 (Soluție 85%); 1.334 g / cm3 Soluție 50%) la 25 ° C.
Densitatea vaporilor
În raport cu aerul 3,4 (aerul = 1).
Aprindere automată
Nu este inflamabil.
Viscozitate
3,86 mPoise (soluție 40% la 20 ° C).
Aciditate
pH: 1,5 (soluție 0,1 N în apă)
pKa: pKa1 = 2,148; pKa2 = 7.198 și pKa3 = 12.319. Prin urmare, hidrogenul dvs. cel mai acid este primul.
Descompunere
Când este încălzit, eliberează oxizi de fosfor. Dacă temperatura crește la 213º C sau mai mult, devine acid pirofosforic (H4PDouăSAU7).
Corozivitate
Coroziv pentru metalele feroase și aluminiu. Reacția cu aceste metale dă naștere la combustibil gaz hidrogen.
Polimerizare
Polimerizează violent cu compuși azoici, epoxizi și compuși polimerizabili.
Aplicații
Săruri de fosfat și utilizări generale
-Acidul fosforic servește ca bază pentru producerea fosfaților, care sunt folosiți ca îngrășăminte, deoarece fosforul este un nutrient principal în plante..
-A fost utilizat în tratamentul otrăvirii cu plumb și în alte condiții în care sunt necesare cantități semnificative de fosfat și producerea de acidoză ușoară.
-Este folosit pentru a controla pH-ul tractului urinar al nurcii și cheltuielile pentru a evita formarea de calculi renali.
-Acidul fosforic dă naștere sărurilor de NaDouăHPO4 și NaHDouăPO4 care constituie un sistem tampon de pH cu un pKa de 6,8. Acest sistem de reglare a pH-ului este prezent la om, fiind important în reglarea pH-ului intracelular, precum și în gestionarea concentrației de hidrogen în tubulii distali și colecționari ai nefronilor..
-Se utilizează la îndepărtarea stratului de mucegai de oxid de fier care se acumulează pe acest metal. Acidul fosforic formează fosfat de fier care poate fi ușor îndepărtat de pe suprafața metalică. Este, de asemenea, utilizat în lustruirea electrică a aluminiului și este un agent de legare pentru produse refractare, cum ar fi alumina și magnezia..
Industrial
-Acidul fosforic este utilizat ca agent catalitic în fabricarea Nylonului și benzinei. Este utilizat ca agent de deshidratare în gravura litografică, în producția de coloranți pentru utilizare în industria textilă, în procesul de coagulare a latexului în industria cauciucului și în purificarea peroxidului de hidrogen.
-Acidul este utilizat ca aditiv în băuturile carbogazoase, contribuind astfel la aroma sa. Diluatul se aplică în procesul de rafinare a zahărului. De asemenea, acționează ca un sistem tampon în prepararea șuncă, gelatină și antibiotice..
-Este implicat în producția de detergenți, în cataliza acidă a producției de acetilenă.
-Este utilizat ca acidulant în alimente echilibrate pentru industria animalelor și animalele de companie. Industria farmaceutică îl folosește la fabricarea medicamentelor antiemetice. Este, de asemenea, utilizat într-un amestec pentru a face asfalt pentru pavarea solului și repararea fisurilor..
-Acidul fosforic acționează ca un catalizator în reacția de hidratare a alchenelor pentru a produce alcool, în principal etanol. În plus, este utilizat la determinarea carbonului organic în soluri.
Dental
Este folosit de medicii stomatologi pentru curățarea și condiționarea suprafeței dintelui înainte de plasarea aparatelor dentare. De asemenea, găsește utilizarea în albirea dinților și îndepărtarea plăcilor dentare. În plus, este utilizat la fabricarea adezivilor pentru proteze dentare.
Produse cosmetice
Acidul fosforic este utilizat pentru reglarea pH-ului în produsele cosmetice și de îngrijire a pielii. Este utilizat ca agent oxidant chimic pentru producerea de cărbune activ..
Formarea acidului fosforic
-Acidul fosforic este preparat din roci fosfatice de tip apatit, prin digestie cu acid sulfuric concentrat:
AC3(PO4)Două + 3 HDouăSW4 + 6 oreDouăO => 2 H3PO4 + 3 (CaSO4.2HDouăSAU)
Acidul fosforic obținut în această reacție are o puritate scăzută, deci suferă un proces de purificare care include precipitarea, extragerea solventului, cristalizarea și tehnicile de schimb ionic..
-Acidul fosforic poate fi produs prin dizolvarea pentoxidului de fosfor în apă clocotită.
-Poate fi obținut și prin încălzirea fosforului cu un amestec de aer și vapori de apă:
P4 (l) + 5 ODouă (g) => P4SAU10 (s)
P4SAU10 (s) + HDouăO (g) => 4H3PO4 (l)
Riscuri
-Deoarece presiunea sa de vapori este scăzută la temperatura camerei, este puțin probabil ca vaporii să fie inhalați, cu excepția cazului în care se pulverizează acid. Dacă da, simptomele de inhalare includ: tuse, dureri în gât, dificultăți de respirație și respirație dificilă..
-Literatura de specialitate menționează cazul unui marinar care a fost expus la vapori de acid fosforic pentru o perioadă lungă de timp. A suferit slăbiciune generală, tuse uscată, dureri în piept și probleme de respirație. În termen de un an de la expunere, s-a observat o disfuncție reactivă a căilor respiratorii.
-Contactul pielii cu acidul fosforic poate provoca roșeață, durere, vezicule și arsuri ale pielii..
-Contactul acidului cu ochii, în funcție de concentrația acestuia și de durata contactului, poate provoca leziuni tisulare corozive sau arsuri severe cu leziuni permanente ale ochilor..
-Ingerarea acidului provoacă arsuri la nivelul gurii și gâtului, senzație de arsură dincolo de stern, dureri abdominale, vărsături, șoc și colaps.
Referințe
- Societatea Regală de Chimie. (2015). Acid fosforic. Luat de pe: chemspider.com
- Centrul canadian pentru securitate și sănătate în muncă. (1999). Acid fosforic - Efecte asupra sănătății. Luat de la: ccsso.ca
- Acids.Info. (2018). Acid fosforic "varietate de utilizări ale acestui compus chimic. Preluat din: acidos.info
- James P. Smith, Walter E. Brown și James R. Lehr. (1955). Structura acidului fosforic cristalin. J. Am. Chem. Soc. 77, 10, 2728-2730
- Wikipedia. (2018). Acizi fosforici și fosfați. Luat de pe: en.wikipedia.org
- Știința este distractivă. Aflați mai multe despre acidul fosforic. [PDF]. Luat de la: scifun.chem.wisc.edu


Nimeni nu a comentat acest articol încă.