
Caracteristici ale acidului și exemple

acizi sunt compuși cu o mare tendință de a dona protoni sau de a accepta o pereche de electroni. Există multe definiții (Bronsted, Arrhenius, Lewis) care caracterizează proprietățile acizilor și fiecare dintre ele este completată pentru a construi o imagine globală a acestui tip de compuși..
Din perspectiva de mai sus, toate substanțele cunoscute pot fi acide, cu toate acestea, numai cele care se remarcă mult peste celelalte sunt considerate ca atare. Cu alte cuvinte: dacă o substanță este un donator de protoni extrem de slab, în comparație cu apa, de exemplu, se poate spune că nu este un acid.

Acesta fiind cazul, care sunt exact acizii și sursele lor naturale? Un exemplu tipic al acestora poate fi găsit în multe fructe: cum ar fi citricele. Limonadele au aroma lor caracteristică datorită acidului citric și a altor componente.
Limba poate detecta prezența acizilor, la fel ca în cazul altor arome. În funcție de nivelul de aciditate al acestor compuși, gustul devine mai intolerabil. În acest fel, limba funcționează ca un contor organoleptic pentru concentrația de acizi, în special concentrația ionului de hidroniu (H3SAU+).
Pe de altă parte, acizii nu se găsesc numai în alimente, ci și în organismele vii. La fel, solurile prezintă substanțe care le pot caracteriza ca fiind acide; acesta este cazul aluminiului și alți cationi metalici.
Indice articol
- 1 Caracteristicile acizilor
- 1.1 - Proprietăți fizice
- 1.2 - Capacitatea de a genera protoni
- 1.3 - Au hidrogeni săraci în densitatea electronilor
- 1.4 - Rezistența sau constanta acidității
- 1.5 - Are baze conjugate foarte stabile
- 1.6 - Pot avea taxe pozitive
- 1.7 - Soluțiile dvs. au valori de pH mai mici de 7
- 1.8 - Capacitatea de a neutraliza bazele
- 2 Acizi tari și acizi slabi
- 3 Exemple de acizi
- 3.1 Halogenuri de hidrogen
- 3.2 Oxoacizi
- 3.3 Superacizi
- 3.4 Acizi organici
- 4 Referințe
Caracteristicile acizilor
Ce caracteristici trebuie să aibă un compus, conform definițiilor existente, pentru a fi considerat acid??
Trebuie să poată genera ioni H+ și OH- atunci când se dizolvă în apă (Arrhenius), trebuie să doneze protoni către alte specii foarte ușor (Bronsted) sau, în cele din urmă, trebuie să poată accepta o pereche de electroni, încărcându-se negativ (Lewis).
Cu toate acestea, aceste caracteristici sunt strâns legate de structura chimică. Prin urmare, învățând să-l analizăm, este posibil să se deducă puterea acidității sau a câtorva compuși, care dintre cei doi este cel mai acid..
- Proprietăți fizice
Acizii au o aromă, merită redundanța, acidul și mirosul lor arde adesea nările. Sunt lichide cu o textură lipicioasă sau uleioasă și au capacitatea de a schimba culoarea hârtiei de turnesol și a metil portocaliu în roșu (Proprietăți ale acizilor și bazelor, S.F.).
- Abilitatea de a genera protoni
În 1923, chimistul danez Johannes Nicolaus Brønsted și chimistul englez Thomas Martin Lowry, au introdus teoria lui Brønsted și Lowry afirmând că orice compus care poate transfera un proton către orice alt compus este un acid (Encyclopædia Britannica, 1998). De exemplu, în cazul acidului clorhidric:
HCl → H+ + Cl-
Teoria lui Brønsted și Lowry nu a explicat comportamentul acid al anumitor substanțe. În 1923 chimistul american Gilbert N. Lewis și-a introdus teoria, în care un acid este considerat ca orice compus care, într-o reacție chimică, este capabil să unească o pereche de electroni care nu sunt împărțiți cu o altă moleculă (Encyclopædia Britannica, 1998).
În acest fel, ioni precum CuDouă+, credinţăDouă+ și credința3+ Au capacitatea de a se lega cu perechi de electroni liberi, de exemplu din apă pentru a produce protoni în felul următor:
CuDouă+ + 2HDouăO → Cu (OH)Două + 2H+
- Au hidrogeni săraci în densitate de electroni
Pentru molecula de metan, CH4, niciunul dintre hidrogenii săi nu are deficiențe electronice. Acest lucru se datorează faptului că diferența de electronegativitate între carbon și hidrogen este foarte mică. Dar, dacă unul dintre atomii de H ar fi înlocuit cu unul de fluor, atunci ar exista o schimbare vizibilă în momentul dipol: HDouăFC-H.
H experimentează o deplasare a norului său de electroni spre atomul adiacent legat de F, care este același, δ + crește. Din nou, dacă un alt H este înlocuit cu un alt F, atunci molecula ar arăta ca: HFDouăC-H.
Acum, δ + este chiar mai mare, deoarece aceștia sunt doi atomi F extrem de electronegativi, care scad densitatea de electroni din C și, în consecință, din C H. Dacă procesul de substituție ar continua, s-ar obține în cele din urmă: F3C-H.
În această ultimă moleculă H prezintă, ca o consecință a celor trei atomi F vecini, o deficiență electronică marcată. Această δ + nu trece neobservată de nicio specie suficient de bogată în electroni pentru a o dezbrăca H și astfel F3CH devin încărcate negativ:
F3C-H + : N- (specie negativă) => F3C:- + HN
De asemenea, ecuația chimică de mai sus poate fi considerată astfel: F3CH donează un proton (H+, H odată detașat de moleculă) a: N; de3CH câștigă o pereche de electroni din H deoarece o altă pereche a fost donată acestuia din urmă de la: N-.
- Puterea acidității sau constantă
Cât de mult F3C:- este prezent în soluție? Sau, câte molecule de F3CH poate dona acid hidrogen la N? Pentru a răspunde la aceste întrebări, este necesar să se determine concentrația de F3C:- sau din HN și, folosind o ecuație matematică, stabiliți o valoare numerică numită constantă de aciditate, Ka.
Cu cât mai multe molecule de F3C:- sau HN sunt produse, cu atât mai mult acid va fi F3CH și mai mare este Ka. În acest fel, Ka ajută la clarificarea cantitativă a compușilor care sunt mai acizi decât alții; și, la fel, îi elimină ca acizi pe cei a căror Ka este de un ordin extrem de mic.
Unele Ka pot avea valori în jur de 10-1 și 10-5, și altele, valorile milionime mai mici, cum ar fi 10-cincisprezece și 10-35. Se poate spune apoi că aceștia din urmă, având aceste constante de aciditate, sunt acizi extrem de slabi și pot fi aruncați ca atare..
Deci, care dintre următoarele molecule are cel mai mare Ka: CH4, CH3F, CHDouăFDouă sau CHF3? Răspunsul constă în lipsa densității electronilor, δ +, în hidrogenii lor..
Măsurători
Dar care sunt criteriile pentru standardizarea măsurătorilor Ka? Valoarea sa poate varia enorm în funcție de speciile care vor primi H+. De exemplu, dacă: N este o bază puternică, Ka va fi mare; dar dacă, dimpotrivă, este o bază foarte slabă, Ka va fi mic.
Măsurătorile Ka se fac folosind cea mai comună și mai slabă dintre toate bazele (și acizii): apa. În funcție de gradul de donație de H+ la moleculele HDouăSau, la 25 ° C și la o presiune de o atmosferă, condițiile standard sunt stabilite pentru a determina constantele de aciditate pentru toți compușii.
Din aceasta rezultă un repertoriu de tabele cu constante de aciditate pentru mulți compuși, atât anorganici, cât și organici..
- Are baze conjugate foarte stabile
Acizii au atomi sau unități (electronice) extrem de electronegative (inele aromatice) în structurile lor chimice care atrag densitățile electronilor din hidrogenii din jur, determinându-i astfel să devină parțial pozitivi și reactivi la o bază.
Odată ce donează protoni, acidul se transformă într-o bază conjugată; adică o specie negativă capabilă să accepte H+ sau donați o pereche de electroni. În exemplul moleculei CF.3H baza sa conjugată este CF3-:
CF3- + HN <=> CHF3 + : N-
Da CF3- este o bază conjugată foarte stabilă, echilibrul va fi deplasat mai mult spre stânga decât spre dreapta. De asemenea, cu cât este mai stabil, cu atât acidul va fi mai reactiv și acid..
De unde știi cât sunt de stabile? Totul depinde de modul în care se ocupă de noua sarcină negativă. Dacă pot să-l delocalizeze sau să difuzeze densitatea electronică în creștere în mod eficient, acesta nu va fi disponibil pentru a fi utilizat în legătură cu baza H..
- Pot avea taxe pozitive
Nu toți acizii au hidrogen cu deficit de electroni, dar pot avea și alți atomi capabili să accepte electroni, cu sau fără o sarcină pozitivă..
Cum este aceasta? De exemplu, în trifluorură de bor, BF3, atomului B îi lipsește un octet de valență, deci poate forma o legătură cu orice atom care îi conferă o pereche de electroni. Dacă un anion F- în apropierea sa, are loc următoarea reacție chimică:
BF3 + F- => BF4-
Pe de altă parte, cationii metalici liberi, cum ar fi Al3+, ZnDouă+, N / A+, etc., sunt considerate acide, deoarece din mediul lor pot accepta legături date (coordonare) ale speciilor bogate în electroni. De asemenea, reacționează cu ionii OH- pentru a precipita sub formă de hidroxizi metalici:
ZnDouă+(aq) + 2OH-(ac) => Zn (OH)Două(s)
Toți aceștia sunt cunoscuți sub numele de acizi Lewis, în timp ce cei care donează protoni sunt acizi Bronsted..
- Soluțiile lor au valori de pH mai mici de 7
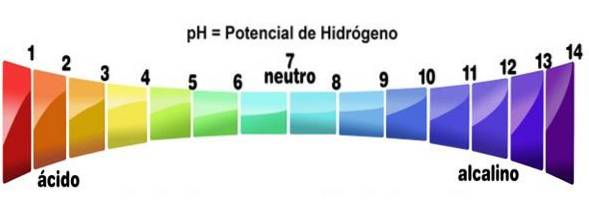
Mai precis, atunci când un acid se dizolvă în orice solvent (care nu îl neutralizează în mod apreciabil), generează soluții cu un pH mai mic de 3, deși sub 7 sunt considerați acizi foarte slabi..
Acest lucru poate fi verificat folosind un indicator acid-bazic, cum ar fi fenolftaleina, indicatorul universal sau sucul de varză purpuriu. Acei compuși care transformă culorile în cele indicate pentru pH scăzut, sunt tratați ca acizi. Acesta este unul dintre cele mai simple teste pentru a determina prezența acestora..
Același lucru se poate face, de exemplu, pentru diferite probe de sol din diferite părți ale lumii, determinând astfel valorile pH-ului lor pentru a le caracteriza, împreună cu alte variabile..
Și, în cele din urmă, toți acizii au arome acre, atâta timp cât nu sunt atât de concentrați încât să ardă ireversibil țesuturile limbii..
- Capacitatea de a neutraliza bazele
Arrhenius, în teoria sa, propune că acizii, prin faptul că pot genera protoni, reacționează cu hidroxilul bazelor pentru a forma sare și apă în felul următor:
HCI + NaOH → NaCl + HDouăSAU.
Această reacție se numește neutralizare și stă la baza tehnicii analitice numite titrare (Bruce Mahan, 1990).
Acizi puternici și acizi slabi
Acizii sunt clasificați în acizi puternici și acizi slabi. Puterea unui acid este asociată constantei sale de echilibru, prin urmare, în cazul acizilor, aceste constante se numesc constante de aciditate Ka.
Astfel, acizii puternici au o constantă acidă mare, astfel încât tind să se disocie complet. Exemple de acești acizi sunt acidul sulfuric, acidul clorhidric și acidul azotic, ale căror constante de acid sunt atât de mari încât nu pot fi măsurate în apă..
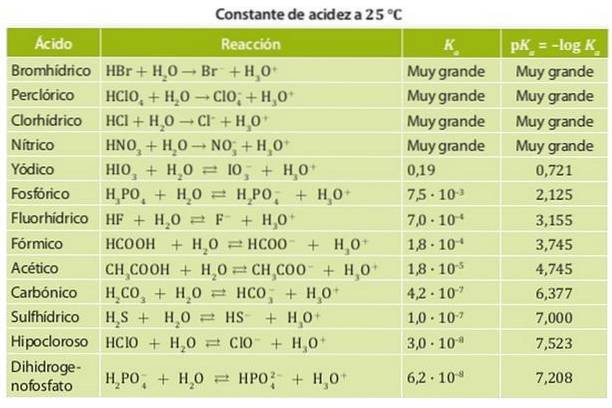
Pe de altă parte, un acid slab este unul a cărui constantă de disociere este scăzută, deci se află în echilibru chimic. Exemple de acești acizi sunt acidul acetic și acidul lactic și acidul azotat ale căror constante de aciditate sunt de ordinul 10-4. Figura 1 arată diferitele constante de aciditate pentru diferiți acizi.
Exemple de acizi
Halogenuri de hidrogen
Toate halogenurile de hidrogen sunt compuși acizi, în special atunci când sunt dizolvați în apă:
-HF (acid fluorhidric).
-HCI (acid clorhidric).
-HBr (acid bromhidric).
-HI (acid iodic).
Oxoacizi
Oxo acizii sunt formele protonate ale oxoanionilor:
HNO3 (acid azotic).
HDouăSW4 (acid sulfuric).
H3PO4 (acid fosforic).
HClO4 (acid percloric).
Super acizi
Superacizii sunt amestecul unui acid Bronsted puternic și un acid Lewis puternic. Odată amestecate formează structuri complexe în care, conform anumitor studii, H+ „Sari” în interiorul lor.
Puterea lor corozivă este de așa natură încât sunt de miliarde de ori mai puternice decât HDouăSW4 concentrat. Acestea sunt folosite pentru a sparge molecule mari prezente în țiței, în molecule mai mici, ramificate și cu o valoare economică adăugată mare..
-BF3/ HF
-SbF5/ HF
-SbF5/ HSO3F
-CF3SW3H
Acizi organici
Acizii organici se caracterizează prin faptul că au una sau mai multe grupări carboxilice (COOH) și printre acestea se numără:
-Acid citric (prezent în multe fructe)
-Acid malic (din mere verzi)
-Acid acetic (din oțet comercial)
-Acid butiric (din untul rânced)
-Acid tartric (din vinuri)
-Și familia acizilor grași.
Referințe
- Torrens H. Acizi și baze dure și moi. [PDF]. Luat de la: depa.fquim.unam.mx
- Helmenstine, Anne Marie, dr. (3 mai 2018). Numele a 10 acizi comuni. Recuperat de pe: thoughtco.com
- Chempages Netorials. Acizi și baze: structură și comportament molecular. Luat de la: chem.wisc.edu
- Deziel, Chris. (27 aprilie 2018). Caracteristici generale ale acizilor și bazelor. Știința. Recuperat de pe: sciencing.com
- Pittsburgh Supercomputing Center (PSC). (25 octombrie 2000). Recuperat de la: psc.edu.


Nimeni nu a comentat acest articol încă.