
Structura clorurii de crom (CrCl3), proprietăți, utilizări
clorură de crom (CrCl3) este o sare anorganică compusă din cationi Cr3+ și anioni Cl- într-un raport 1: 3; adică pentru fiecare Cr3+ sunt trei Cl-. După cum se va vedea mai târziu, interacțiunile lor nu sunt ionice. Această sare poate fi prezentată în două forme: anhidru și hexahidrat..
Forma anhidră se caracterizează prin faptul că are o culoare roșiatică-violetă; în timp ce hexahidratul, CrCl3.6HDouăSau este verde închis. Incorporarea moleculelor de apă modifică proprietățile fizice ale cristalelor menționate; precum punctele lor de fierbere și topire, densitățile etc..

Clorura de crom (III) (conform nomenclaturii stocului) se descompune la temperaturi ridicate, transformându-se în clorură de crom (II), CrClDouă. Este coroziv pentru metale, deși este utilizat în placarea cu crom: o procedură în care metalele sunt acoperite cu un strat subțire de crom.
Cr3+, Provenind din clorura respectivă, a fost utilizat în tratamentul diabetului, în special la pacienții cu nutriție parenterală totală (TPN), care nu ingeră cantitatea necesară de crom. Cu toate acestea, rezultatele sunt mult mai bune (și mai fiabile) dacă sunt furnizate sub formă de picolinat..
Indice articol
- 1 Structura clorurii de crom
- 1.1 Straturi cristaline de anhidru
- 2 Proprietăți
- 2.1 Denumiri
- 2.2 Formula chimică
- 2.3 Greutate moleculară
- 2.4 Descrierea fizică
- 2.5 Punct de topire
- 2.6 Punctul de fierbere
- 2.7 Solubilitatea în apă
- 2.8 Solubilitatea în solvenți organici
- 2.9 Densitate
- 2.10 Temperatura de depozitare
- 2.11 Descompunerea
- 2.12 Coroziune
- 2.13 Reacții
- 2,14 pH
- 3 Sinteza
- 4 utilizări
- 4.1 Industrial
- 4.2 Terapie
- 5 Riscuri
- 6 Referințe
Structura clorurii de crom
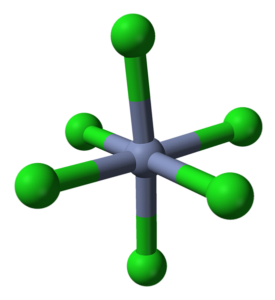
CrCl3 Deși este o sare, natura interacțiunilor sale nu este pur ionică; au un anumit caracter covalent, produs al coordonării dintre Cr3+ și Cl-, care dau naștere unui octaedru deformat (imaginea superioară). Cromul este situat în centrul octaedrului, iar clorurile în vârfurile sale.
Octaedrul CrCl6 poate, la prima vedere, să contrazică formula CrCl3; totuși, acest octaedru complet nu definește celula unitară a cristalului, ci mai degrabă un cub (de asemenea deformat), care taie sferele verzi sau anionii de clor în jumătate.
Straturi cristaline anhidre
Astfel, celula unitară cu acest octaedru menține încă raportul 1: 3. Prin reproducerea acestor cuburi deformate în spațiu, se obține cristalul CrCl3, care este reprezentat în imaginea superioară cu un model de umplere tridimensională și un model de sfere și bare.

Acest strat cristalin este unul dintre multele care alcătuiesc cristalele fulgi de roșu-violet ale CrCl.3 (nu confundați culoarea cristalului, adevărată, cu cea a sferelor verzi).
După cum se poate observa, anionii Cl- ocupă suprafața, astfel încât sarcinile lor negative resping celelalte straturi cristaline. În consecință, cristalele devin fragile și fragile; dar strălucitor, din cauza cromului.
Dacă aceleași straturi sunt vizualizate dintr-o perspectivă laterală, se vor observa, în loc de octaedre, tetraedre distorsionate:
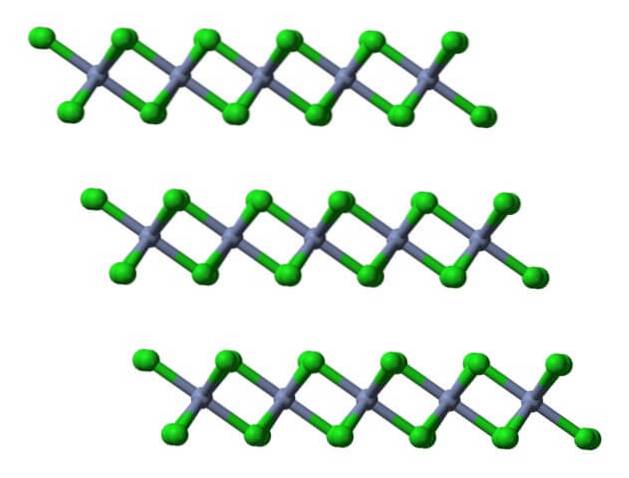
Aici este facilitată înțelegerea de ce straturile se resping reciproc atunci când anionii Cl se leagă.- a suprafețelor lor.
Proprietăți
Numele
-Clorură de crom (III)
-Triclorură de crom (III)
-Clorură de crom (III) anhidră.
Formula chimica
-CrCl3 (anhidru).
-CrCl3.6HDouăO (hexahidrat).
Greutate moleculară
-158,36 g / mol (anhidru).
-266,43 g / mol (hexahidrat).
Descriere Fizica
-Solide și cristale roșiatice-violete (anhidre).
-Pulbere cristalină verde închis (hexahidrat, imaginea de jos). În acest hidrat se poate vedea cum apa inhibă strălucirea, o caracteristică metalică a cromului.

Punct de topire
-1.152 ºC (2.106 ºF, 1.425 K) (anhidru)
-83 ºC (hexahidrat).
Punct de fierbere
1300ºC (2.370ºF, 1.570) (anhidru).
Solubilitatea apei
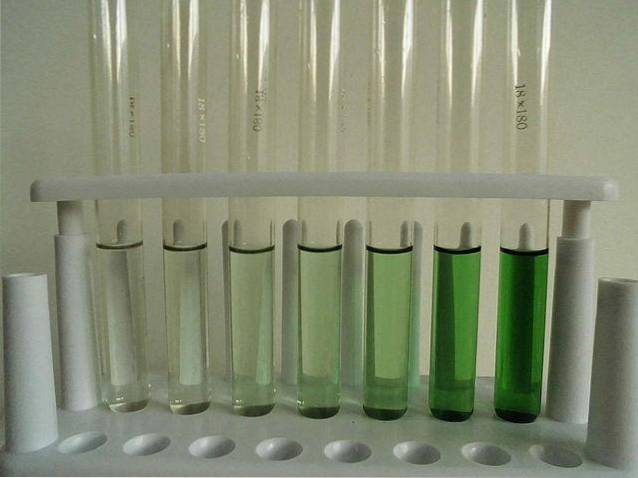
-Ușor solubil (anhidru).
-585 g / L (hexahidrat).
Imaginea de mai sus prezintă o serie de eprubete umplute cu o soluție apoasă de CrCl3. Rețineți că cu cât este mai concentrat, cu atât culoarea complexului este mai intensă [Cr (OHDouă)6]3+, responsabil pentru culoarea verde.
Solubilitate în solvenți organici
Solubil în etanol, dar insolubil în eter (anhidru).
Densitate
-2,87 gr / cm3 (anhidru).
-2,76 g / cm3 (hexahidrat).
Temperatura de depozitare
Descompunere
Când este încălzită până la descompunere, clorura de crom (III) emite vapori toxici de compuși care conțin clor. Acești compuși sunt eliberați și atunci când clorura de crom (III) intră în contact cu acizii puternici..
Coroziune
Este foarte coroziv și poate ataca anumite oțeluri.
Reacții
Este incompatibil cu oxidanții puternici. De asemenea, reacționează puternic cu litiu și azot..
Când este încălzit în prezența hidrogenului, acesta se reduce la clorură de crom (II), cu formarea de clorură de hidrogen.
2 CrCl3 + HDouă => 2 CrClDouă + 2 HCI
pH
Într-o soluție apoasă și cu o concentrație de 0,2 M: 2,4.
Sinteză
Clorura de crom (III) hexahidrat este produsă prin reacția hidroxidului de crom cu acidul clorhidric și apa.
Cr (OH)3 + 3 HCI + 3 HDouăO => CrCl3.6HDouăSAU
Apoi, pentru a obține sarea anhidră, CrCl este încălzit3.6HDouăSau în prezența clorurii de tionil, SOClDouă, acid clorhidric și căldură:
[Cr (HDouăSAU)6] Cl3 + 6SOClDouă + ∆ → CrCl3 + 12 HCI + 6SODouă
Alternativ, CrCl3 obținută prin trecerea clorului gazos peste un amestec de crom și oxid de carbon.
CrDouăSAU3 + 3 C + ClDouă => 2 CrCl3 + 3 CO
Și, în cele din urmă, fiind cea mai utilizată metodă, este încălzirea oxidului său cu un agent de halogenare, cum ar fi tetraclorura de carbon:
CrDouăSAU3 + 3CCl4 + ∆ → 2CrCl3 + 3COClDouă
Aplicații
Industrial
Clorura de crom este implicată în prepararea in situ a clorurii de crom (II); reactiv implicat în reducerea halogenurilor de alchil și în sinteza halogenurilor de (E) -alchenil.
-Se folosește în tehnica de placare cu crom. Aceasta constă în depunerea, prin intermediul galvanizării, a unui strat subțire de crom pe obiecte metalice sau alt material cu obiectiv decorativ, crescând astfel rezistența la coroziune și, de asemenea, duritatea suprafeței..
-Este folosit ca mordant textil, servind ca o legătură între materialul de vopsit și țesăturile de vopsit. În plus, este utilizat ca catalizator pentru producerea de olefine și agenți de impermeabilizare..
Terapeutică
Utilizarea suplimentului de clorură de crom USP este recomandată la pacienții care primesc doar soluții intravenoase, administrate pentru nutriție parenterală totală (TPN). Prin urmare, numai atunci când acești pacienți nu primesc toate necesitățile lor nutriționale.
Cromul (III) face parte din factorul de toleranță la glucoză, un activator al reacțiilor care favorizează insulina. Se crede că cromul (III) activează metabolismul glucozei, proteinelor și lipidelor, facilitând acțiunea insulinei la oameni și animale.
Cromul este prezent în multe alimente. Dar concentrația sa nu depășește 2 pe porție, broccoli fiind alimentul cu cea mai mare contribuție (11 µg). În plus, absorbția intestinală a cromului este scăzută, cu o valoare de 0,4 până la 2,5% din cantitatea ingerată..
Acest lucru face dificilă stabilirea unei diete pentru furnizarea de crom. În 1989, Academia Națională de Științe a recomandat între 50 și 200 µg / zi ca aport adecvat de crom..
Riscuri
Printre riscurile posibile ale consumului de sare ca supliment de crom se numără:
-Dureri severe de stomac.
-Sângerări anormale, care pot varia de la dificultăți în vindecarea unei răni, vânătăi mai roșii sau întunecarea scaunului din sângerări interne.
-Iritații ale sistemului digestiv, cauzând ulcere în stomac sau intestine.
-Dermatită
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Wikipedia. (2019). Clorură de crom (III). Recuperat de pe: en.wikipedia.org
- Clorură de crom (III) [PDF]. Recuperat de la: alpha.chem.umb.edu
- PubChem. (2019). Clorură de crom hexahidrat. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Institute Naționale de Sănătate. (21 septembrie 2018). Crom: Fișă informativă despre suplimentul alimentar. Recuperat de la: ods.od.nih.gov
- Tomlinson Carole A. (2019). Efecte secundare ale clorurii de crom. Leaf Group Ltd. Recuperat de la: healthfully.com



Nimeni nu a comentat acest articol încă.