
Proprietăți, structură, utilizări ale clorurii de plumb
clorură de plumb este o sare anorganică a cărei formulă chimică este PbCln, unde n este numărul de oxidare al plumbului. Deci, atunci când plumbul este +2 sau +4, sarea este PbClDouă sau PbCl4, respectiv. Prin urmare, există două tipuri de cloruri pentru acest metal.
Dintre cele două, PbClDouă este cel mai important și stabil; în timp ce PbCl4 este instabil și mai puțin util. Primul este de natură ionică, unde cationul PbDouă+ generează interacțiuni electrostatice cu anionul Cl- pentru a construi o rețea de cristal; iar al doilea este covalent, cu legături Pb-Cl originând un tetraedru de plumb și clor.

O altă diferență între cele două cloruri de plumb este aceea că PbClDouă Este un solid de cristale albe cu formă de ace (imagine superioară); în timp ce PbCl4 Este un ulei gălbui care poate cristaliza la -15 ° C. Intrare PbClDouă este mai estetic decât PbCl4.
Pe lângă cele menționate deja, PbClDouă se găsește în natură ca cotunit mineral; în timp ce PbCl4 nu, deoarece este susceptibil de descompunere. Deși din PbCl4 puteți obține PbODouă, de PbClDouă derivă o varietate nesfârșită de compuși organometalici.
Indice articol
- 1 Proprietăți
- 1.1 -Clorură de plumb (II)
- 1.2 Clorură de plumb (IV)
- 2 Structura
- 2.1 -Clorură de plumb (II)
- 2.2 Molecula în fază gazoasă
- 3 Nomenclatură
- 4 utilizări
- 5 Referințe
Proprietăți
Proprietățile clorurii de plumb depind în esență de numărul de oxidare al plumbului; deoarece clorul nu se schimbă, dar modul în care interacționează cu plumbul se schimbă. Prin urmare, ambii compuși trebuie tratați separat; clorură de plumb (II) pe de o parte și clorură de plumb (IV) pe de altă parte.
-Clorură de plumb (II)
Masă molară
278,10 g / mol.
Aspectul fizic
Cristale de culoare albă, cu forme de ac.
Densitate
5,85 g / ml.
Punct de topire
501ºC.
Punct de fierbere
950ºC.
Solubilitatea apei
10,8 g / L la 20 ° C. Este slab solubilă și apa trebuie încălzită astfel încât să se poată dizolva o cantitate considerabilă.
Indicele de refracție
2.199.
Clorură de plumb (IV)
Masă molară
349,012 g / mol.
Aspectul fizic
Lichid uleios gălbui.
Densitate
3,2 g / ml.
Punct de topire
-15ºC.
Punct de fierbere
50 ° C. La temperaturi mai ridicate se descompune eliberând clor gazos:
PbCl4(s) => PbClDouă(s) + ClDouă(g)
De fapt, această reacție poate deveni foarte explozivă, astfel încât PbCl este stocat.4 în acid sulfuric la -80ºC.
Structura
-Clorură de plumb (II)
La început s-a menționat că PbClDouă este un compus ionic, deci este format din ioni PbDouă+ și Cl- care construiesc un cristal în care este stabilit un raport Pb: Cl egal cu 1: 2; adică există de două ori mai mulți anioni Cl- ce cationi PbDouă+.
Rezultatul este că se formează cristale ortorombice ale căror ioni pot fi reprezentați cu un model de sfere și bare ca în imaginea de mai jos..

Această structură corespunde, de asemenea, cu cea a mineralului cotunit. Deși barele sunt folosite pentru a indica o direcționalitate a legăturii ionice, aceasta nu trebuie confundată cu o legătură covalentă (sau cel puțin pur covalentă).
În aceste cristale ortorombice PbDouă+ (sferele cenușii) are nouă Cl- (sfere verzi) care îl înconjoară, de parcă ar fi fost închis într-o prismă triunghiulară. Datorită complexității structurii și densității ionice scăzute a PbDouă+, este dificil pentru molecule să solvate cristalul; motiv pentru care este slab solubil în apă rece.
Molecula de fază gazoasă
Când nici cristalul, nici lichidul nu pot rezista la temperaturile ridicate, ionii încep să se vaporizeze ca molecule de PbCl.Două discret; adică cu legături covalente Cl-Pb-Cl și un unghi de 98º, ca și cum ar fi un bumerang. Se spune apoi că faza gazoasă constă din aceste molecule de PbClDouă și niciunul de ioni transportați de curenții de aer.
Clorură de plumb (IV)
Între timp, PbCl4 este un compus covalent. De ce? Deoarece cationul Pb4+ este mai mic și are, de asemenea, o densitate a sarcinii ionice mai mare decât PbDouă+, ceea ce determină o polarizare mai mare a norului de electroni Cl-. Rezultatul este că în loc de o interacțiune de tip ionic Pb4+Cl-, se formează legătura covalentă Pb-Cl.
Având în vedere acest lucru, asemănarea dintre PbCl4 și, de exemplu, CCl4; ambele apar ca molecule tetraedrice unice. Astfel, se explică de ce această clorură de plumb este un ulei gălbui în condiții normale; Atomii de Cl sunt slab legați între ei și „alunecă” atunci când două molecule de PbCl4 vin.
Cu toate acestea, atunci când temperatura scade și moleculele încetinesc, probabilitatea și efectele dipolilor instantanei (PbCl4 este apolar având în vedere simetria sa); și apoi uleiul îngheață sub formă de cristale hexagonale galbene:
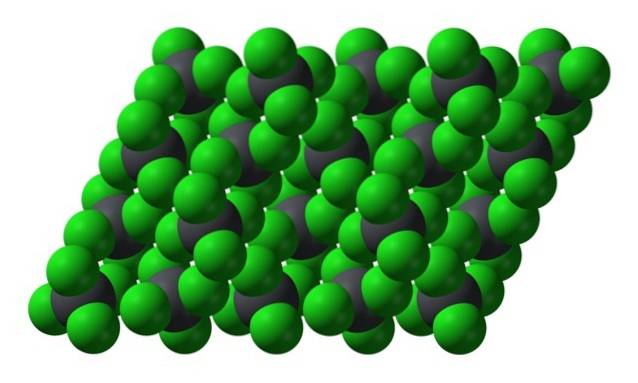
Rețineți că fiecare sferă cenușie este înconjurată de patru sfere verzi. Aceste molecule de PbCl4 „Strâns împreună” alcătuiesc un cristal instabil, care este susceptibil de descompunere viguroasă.
Nomenclatură
Denumirile: clorură de plumb (II) și clorură de plumb (IV) corespund celor atribuite în conformitate cu nomenclatura stoc. Deoarece numărul de oxidare +2 este cel mai mic pentru plumb și +4 cel mai mare, ambele cloruri pot fi denumite în conformitate cu nomenclatura tradițională drept clorură de plumboză (PbClDouă) și clorură de plumb (PbCl4), respectiv.
Și, în cele din urmă, există nomenclatura sistematică, care evidențiază numărul fiecărui atom din compus. Astfel, PbClDouă este diclorura de plumb și PbCl4 tetraclorură de plumb.
Aplicații
Nu există o utilizare practică cunoscută pentru PbCl4 pe lângă faptul că servește pentru sinteza PbODouă. Cu toate acestea, PbClDouă Este mai util și de aceea doar câteva utilizări pentru această clorură de plumb specifică vor fi enumerate mai jos:
- Datorită naturii sale extrem de luminescente, este destinat dispozitivelor fotografice, acustice, optice și de detectare a radiațiilor.
- Deoarece nu se absoarbe în regiunea spectrului infraroșu, este utilizat pentru fabricarea ochelarilor care transmit acest tip de radiații.
- A făcut parte din ceea ce se numește sticlă aurie, un material atrăgător cu colorații albăstrui irizate folosite în scopuri ornamentale..
- De asemenea, continuând pe subiectul artei, atunci când este alcalinizat, PbClDouăPb (OH)Două Câștigă tonuri albicioase intense, fiind folosit ca pigment de plumb alb. Cu toate acestea, utilizarea sa a fost descurajată datorită toxicității sale ridicate..
- Topit și amestecat cu titanat de bariu, BaTiO3, provine titanatul de bariu din plumb ceramic Ba1 - xPbXUnchiule3. Dacă un PbDouă+ intrați în BaTiO3, un BaDouă+ trebuie să părăsească cristalul pentru a permite încorporarea acestuia, iar apoi se spune că are loc un schimb de cationi; de aici și compoziția BaDouă+ este exprimat ca 1-x.
- Și în cele din urmă, din PbClDouă sunt sintetizați mai mulți compuși organometalici de plumb cu formula generală R4Pb sau R3Pb-PbR3.
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Wikipedia. (2019). Clorură de plumb (II). Recuperat de pe: en.wikipedia.org
- Formulare chimică. (2019). Clorură de plumb (IV). Recuperat de pe: formulacionquimica.com
- Clark Jim. (2015). Clorurile de carbon, siliciu și plumb. Recuperat de pe: chemguide.co.uk
- Studii neliniare spectrale și optice asupra clorurii de plumb (PbClDouă) cristale. [PDF]. Recuperat de la: shodhganga.inflibnet.ac.in
- Centrul Național pentru Informații despre Biotehnologie. (2019). Clorură de plumb. Baza de date PubChem; CID = 24459. Recuperat de la: pubchem.ncbi.nlm.nih.gov


Nimeni nu a comentat acest articol încă.