
Coeficientul de partiție de distribuție, distribuție, aplicații
coeficientul de partiție sau distribuția Este definit ca raportul dintre concentrația unei specii chimice sau a unui substanță dizolvată între două medii în echilibru. Acest mediu poate fi un gaz ca aerul; un lichid precum apa sau uleiul; sau un amestec complex precum sânge sau alte țesuturi.
Coeficientul de partiție sânge / aer este important pentru a explica schimbul de gaze care are loc în plămâni, între sânge și atmosferă..
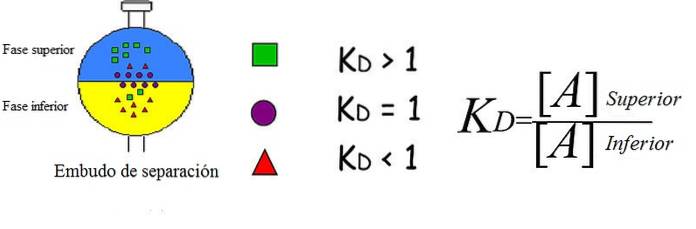
Imaginea de mai sus demonstrează într-un mod simplificat și strălucitor conceptul explicat. Fiecare figură reprezintă un analit, care sunt distribuite și / sau distribuite între două faze nemiscibile: una superioară și cealaltă inferioară..
Pătratele verzi sunt predominant în faza superioară; în timp ce triunghiurile roșii se dizolvă mai mult în faza inferioară, iar cercurile violete aleg să se afle la interfață.
Puteți vedea cum variază KD pentru fiecare analit. Dacă KD este mai mare de 1, analitul va distribui mai mult spre faza superioară; dacă valoarea sa este apropiată de 1, va tinde să fie localizată pe interfață; sau dacă dimpotrivă KD este mai mic de 1, va fi în principal în faza inferioară.
Una dintre formele coeficientului de partiție este cea dintre două lichide nemiscibile în echilibru; ca și sistemul n-octanic și apa. Acest sistem a fost utilizat pentru a stabili o proprietate importantă a unui compus: caracterul său hidrofob sau hidrofil..
Valoarea coeficientului de partiție (P) sau a coeficientului de partiție (K) servește pentru a indica hidrofobia unui medicament. Astfel, poate fi folosit pentru a prezice absorbția intestinală, distribuția, metabolismul și procesul de excreție..
Indice articol
- 1 Coeficientul de partiție
- 1.1 Definiție
- 1.2 Interpretare
- 1.3 Coeficientul de partiție octanol / apă
- 1.4 Restricții
- 2 Coeficient de distribuție (D)
- 3 Determinarea experimentală a unui coeficient de partiție
- 3.1 Metoda de agitare a balonului
- 3.2 Metoda de cromatografie lichidă de înaltă performanță
- 4 Aplicații
- 4.1 Optimizarea acțiunii drogurilor
- 4.2 Produse agrochimice
- 4.3 Îngrijirea mediului
- 5 Referințe
Coeficientul de partiție
Definiție
Coeficientul de partiție (K) al unei substanțe, numit și coeficientul de partiție (P), este coeficientul împărțirii concentrațiilor unei substanțe în două faze; alcătuit din amestecul a doi solvenți care sunt nemiscibili datorită densităților și naturii lor diferite.
Valoarea coeficientului de partiție (K) sau partiției (P) este legată de diferența de solubilitate a substanței în lichidele nemiscibile care fac parte din amestec.
K sau P = [substanță]1 / [substanță]Două
[substanţă]1 este concentrația substanței în lichid 1. Y [substanță]Două este concentrația aceleiași substanțe în lichidul 2.
Interpretare
Dacă K sau P are o valoare egală cu 3, indică faptul că substanța este de 3 ori mai concentrată în lichidul 1 decât în lichidul 2. Dar, în același timp, indică și faptul că substanța este mai solubilă în lichidul 1.
Acum, dacă valoarea lui K sau P este 0,3, substanța are o concentrație mai mare în lichidul 2; și, prin urmare, solubilitatea sa este mai mare în lichidul 2 decât în lichidul 1.
Coeficientul de partiție octanol / apă
În unele domenii de cercetare, cum ar fi chimia organică și produsele farmaceutice, amestecul de lichide este alcătuit din apă și un lichid apolar, cum ar fi n-octanol sau 1-octanol, motiv pentru care este adesea menționat coeficientul de partiție a octanolului. / Apă reprezentată de Pow.
N-octanolul are o densitate de 0,824 g / cm3; în timp ce apa, după cum se știe, are o densitate de 1 g / cm3 aproximativ constantă. Odată ce cele două lichide au fost echilibrate, n-octanolul ocupă partea superioară a amestecului de lichide nemiscibile, care a fost numit lichid 1.
O substanță hidrofobă va avea o concentrație mai mare în n-octanol, odată ce lichidele nemiscibile se vor echilibra. Pe de altă parte, o substanță hidrofilă va avea o concentrație mai mare în apă..
Restricții
Coeficientul de partiție sau distribuție se aplică substanțelor neionizate. În cazul în care coeficientul de partiție este măsurat într-o substanță ionizabilă, pH-ul trebuie ajustat sau trebuie utilizat un tampon în faza apoasă pentru a se asigura că substanța apare ca nedisociată.
La determinarea coeficientului de partiție, nu trebuie utilizate substanțe tensioactive sau surfactante, deoarece aceste substanțe, datorită naturii lor amfifile, sunt situate la interfața lichidelor nemiscibile..
Coeficientul de partiție n-octanol / apă este de obicei exprimat în formă logaritmică; adică ca log P sau log K, datorită amplitudinii valorilor lui P și K.
Dacă jurnalul lui P pentru o substanță este mai mare de 0, acest lucru indică faptul că substanța este hidrofobă. Dimpotrivă, dacă jurnalul lui P este mai mic de 0 (adică negativ), acest lucru va indica faptul că substanța este hidrofilă..
Coeficient de distribuție (D)
Coeficientul de distribuție (D) este coeficientul dintre concentrația tuturor substanțelor, ionizate și neionizate, în lichidul 1 (n-octanol) și concentrația acelorași substanțe în lichidul 2 (apă).
Odată ce s-a obținut valoarea coeficientului de distribuție (D), acesta poate fi exprimat ca un logaritm al lui D datorită amplitudinii valorilor lui D.
Pentru a obține coeficientul de distribuție (D), faza apoasă trebuie tamponată; adică la un anumit pH, care trebuie indicat la referirea la valoarea coeficientului de distribuție obținut.
Este convenabil să se efectueze determinarea D la pH 7,4. Acest pH corespunde cu cel al sângelui și reprezintă condițiile pe care medicamentele sau compușii le vor întâlni în mediul intracelular și în mediul extracelular..
Pentru un compus neionizabil, log D = log P, indiferent de pH-ul utilizat.
Determinarea experimentală a unui coeficient de partiție
Există mai multe metode de măsurare a coeficientului de partiție (P). Acestea includ metoda balonului de agitare și cromatografia lichidă de înaltă performanță. Ambele necesită cunoașterea prealabilă a solubilității substanței testate, atât în n-octanol, cât și în apă..
Metoda de agitare a balonului
Proba este dizolvată în n-octanol saturat cu apă, care va fi partiționat într-o pâlnie de separare sau decantare cu apă saturată cu n-octanol. Saturația solvenților este necesară pentru a evita transferul solventului în timpul procesului de partiționare.
Pâlnia de separare este supusă agitării mecanice pentru un anumit timp. Apoi, este lăsat să stea mult timp pentru a asigura o separare completă. În concluzie, fazele sunt separate prin decantare.
Apoi, concentrația probei în fiecare dintre solvenți este determinată folosind o metodă spectrofotometrică; ex. UV-Visible sau altă metodă. În cele din urmă, cu datele obținute, se vor calcula coeficientul de partiție și logul P..
Această metodă are avantajul că este ieftină, reproductibilă și de înaltă precizie. Pe scurt, este cea mai fiabilă metodă de determinare a jurnalului P.
Principalul dezavantaj al metodei este că consumă mult timp: mai mult de 24 de ore pentru a efectua echilibrarea lichidului, agitarea și separarea fazelor în timpul procesului de partiționare. În plus, se aplică numai substanțelor solubile în n-octanol și apă..
Metoda de cromatografie lichidă de înaltă performanță
Jurnalul P poate fi obținut prin corelarea timpului de retenție al probei cu timpul de retenție al unui compus de referință cu structură chimică similară cu o valoare P cunoscută..
Este o metodă în care valoarea log P este obținută într-un timp mai mic de 20 de minute. Oferă valori log p între 0 și 6, ceea ce corespunde doar substanțelor hidrofobe.
Dezavantajul este că valoarea P este determinată de regresie liniară, deci ar trebui folosiți ca referință mai mulți compuși cu o structură chimică similară eșantionului și valorile log P cunoscute..
Aplicații
Optimizarea acțiunii drogurilor
Dacă un medicament este ingerat, acesta trebuie să ajungă la lumenul intestinului subțire, unde sunt absorbite majoritatea substanțelor. Apoi, trece prin interiorul celulelor, dizolvându-se în bistratul lipidic care face parte din membrană. Acest proces este favorizat de natura hidrofobă a medicamentului..
Medicamentul trebuie să treacă prin celulele intestinale, traversând membrana bazală pentru a ajunge la sânge și a ajunge la receptorii țintă pentru acțiunea medicamentului. Unele etape ale procesului general sunt favorizate de natura hidrofobă a medicamentului, dar altele nu..
Trebuie găsită o valoare a coeficientului de partiție care să permită toate procesele necesare pentru acțiunea medicamentului și bunăstarea organismului să fie satisfăcătoare.
Utilizarea medicamentelor excesiv de hidrofobe poate fi toxică, deoarece metabolismul lor poate produce metaboliți potențial dăunători. Pe de altă parte, medicamentele total hidrofile prezintă dificultăți de absorbție intestinală..
Agrochimice
Activitatea insecticidelor și erbicidelor este influențată de natura lor hidrofobă. Cu toate acestea, hidrofobicitatea este asociată cu un timp de înjumătățire mai lung. Prin urmare, efectul poluant asupra mediului este prelungit și poate provoca daune ecologice..
Produsele hidrofobe eficiente trebuie produse cu un timp de înjumătățire mai scurt.
Îngrijirea mediului
Compușii hidrofobi sunt de obicei poluanți pentru mediu, deoarece sunt drenați prin sol, putând ajunge la apele subterane și mai târziu la apele râurilor..
Cunoscând coeficientul de partiție al unui compus, se pot face modificări în structura sa chimică, care îi modifică hidrofobia pentru a reduce acțiunea sa poluantă asupra mediului..
Hidrogeologia folosește coeficientul de partiție octanol / apă (Kow) pentru a controla fluxul compușilor hidrofobi, atât în sol, cât și în apele subterane.
Referințe
- Bannan, C. C., Calabró, G., Kyu, D. Y. și Mobley, D. L. (2016). Calculul coeficienților de partiție a moleculelor mici în octanol / apă și ciclohexan / apă. Jurnal de teorie chimică și calcul, 12(8), 4015-4024. doi: 10.1021 / acs.jctc.6b00449
- Wikipedia. (2019). Coeficientul de partiție. Recuperat de pe: es.wikipedia.org
- Universitatea națională din Columbia. (s.f.). Unitatea 8: Determinarea experimentală a coeficientului de partiție barbiturică. [PDF]. Recuperat de pe: red.unal.edu.co
- Sevierul. (2019). Coeficientul de partiție. Știință directă. Recuperat de pe: sciencedirect.com
- Seeboo Hemnath. (2019). Coeficientul partiției: definiție și calcul. Studiu. Recuperat de la: study.com



Nimeni nu a comentat acest articol încă.