
Co-precipitare în ce constă, tipuri și aplicații

co-precipitare Este contaminarea unei substanțe insolubile care transportă substanțe dizolvate dizolvate din mediul lichid. Aici, cuvântul „contaminare” este aplicat pentru acele cazuri în care nu sunt de dorit solutii solubili precipitați de un suport insolubil; dar atunci când nu sunt, există o metodă analitică sau sintetică alternativă.
Pe de altă parte, suportul insolubil este substanța precipitată. Aceasta poate transporta soluția solubilă în interior (absorbție) sau pe suprafața sa (adsorbție). Modul în care îl faceți va schimba complet proprietățile fizico-chimice ale solidului rezultat..
Deși conceptul de co-precipitație poate părea puțin confuz, este mai frecvent decât ați putea crede. De ce? Deoarece, mai mult decât solide simple contaminate, se formează soluții solide de structuri complexe și bogate în componente neprețuite. Solul din care sunt hrănite plantele sunt exemple de co-precipitații.
De asemenea, mineralele, ceramica, argilele și impuritățile din gheață sunt, de asemenea, produsul acestui fenomen. În caz contrar, solurile ar pierde o mare parte din elementele lor esențiale, mineralele nu ar fi așa cum sunt cunoscute în prezent și nu ar exista o metodă importantă pentru sinteza materialelor noi..
Indice articol
- 1 Ce este co-precipitația?
- 2 tipuri
- 2.1 Incluziune
- 2.2 Ocluzia
- 2.3 Adsorbție
- 3 Aplicații
- 4 Referințe
Ce este co-precipitația?
Pentru a înțelege mai bine ideea co-precipitațiilor, este oferit următorul exemplu.
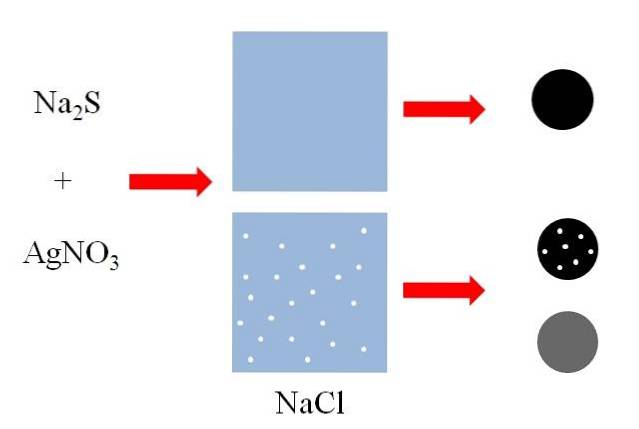
Deasupra (imaginea superioară) există două recipiente cu apă, dintre care unul conține NaCI dizolvat. NaCl este o sare foarte solubilă în apă, dar dimensiunile punctelor albe sunt exagerate din motive explicative. Fiecare punct alb va deveni agregate mici de NaCI într-o soluție pe punctul de a se satura.
Un amestec de sulfură de sodiu, NaDouăS și azotat de argint, AgNO3, va precipita un solid negru insolubil de sulfură de argint, AgS:
N / ADouăS + AgNO3 => AgS + NaNO3
După cum se poate vedea în primul recipient cu apă, precipită un solid negru (sferă neagră). Cu toate acestea, acest solid din recipientul cu NaCI dizolvat transportă particule din această sare (sferă neagră cu puncte albe). NaCl este solubil în apă, dar când AgS precipită, este adsorbit pe suprafața neagră.
Se spune apoi că NaCl a coprecipitat pe AgS. Dacă solidul negru ar fi analizat, micro-cristale de NaCI ar putea fi văzute la suprafață.
Cu toate acestea, aceste cristale ar putea fi, de asemenea, în interiorul AgS, astfel încât solidul ar „deveni” cenușiu (alb + negru = gri).
Tipuri
Sfera neagră cu puncte albe și sfera gri arată că un dizolvat solubil poate co-precipita în moduri diferite..
În prima, o face superficial, adsorbită pe suportul insolubil (AgS în exemplul anterior); în timp ce în al doilea, o face intern, „schimbând” culoarea neagră a precipitatului.
Puteți obține alte tipuri de solide? Adică o sferă cu faze alb-negru, adică de AgS și NaCl (împreună cu NaNO3 care coprecipitează și). Aici apare ingeniozitatea sintezei de noi solide și materiale.
Cu toate acestea, întorcându-ne la punctul de plecare, în esență coprecipitații de solut solubil generând diferite tipuri de solide. Tipurile de coprecipitare și solidele care rezultă din acestea vor fi menționate mai jos..
Includere
Vorbim de incluziune atunci când în rețeaua de cristal, unul dintre ioni poate fi înlocuit cu unul dintre substanța solubilă co-precipitată.
De exemplu, dacă NaCl ar fi co-precipitat prin incluziune, ionii de Na+ ar fi luat locul lui Ag+ într-o secțiune a aranjamentului de cristal.
Cu toate acestea, dintre toate tipurile de co-precipitații, aceasta este cea mai puțin probabilă; deoarece, pentru ca aceasta să se întâmple, razele ionice trebuie să fie foarte asemănătoare. Revenind la sfera gri a imaginii, incluziunea va ajunge să fie reprezentată de unul dintre tonurile cenușii mai deschise.
Așa cum am menționat, includerea se face în solidele cristaline și, pentru a le obține, trebuie să se stăpânească chimia soluțiilor și mai mulți factori (T, pH, timp de agitare, raporturi molare etc.).
Ocluzie
În ocluzie, ionii sunt prinși în rețeaua de cristal, dar fără a înlocui niciun ion din matrice. De exemplu, se pot forma cristale de NaCI ocluse în AgS. Grafic, ar putea fi vizualizat ca un cristal alb înconjurat de cristale negre.
Acest tip de co-precipitare este unul dintre cele mai frecvente și, datorită acesteia, există sinteza noilor solide cristaline. Particulele ocluse nu pot fi îndepărtate cu o simplă spălare. Pentru a face acest lucru, ar fi necesar să recristalizăm întregul ansamblu, adică suportul insolubil.
Atât incluziunea, cât și ocluzia sunt procese de absorbție date în structurile cristaline.
Adsorbţie
La adsorbție, solidul coprecipitat se află pe suprafața suportului insolubil. Mărimea particulelor acestui suport definește tipul de solid obținut.
Dacă sunt mici, se va obține un solid coagulat, din care este ușor de îndepărtat impuritățile; dar dacă sunt foarte mici, solidul va absorbi cantități abundente de apă și va fi gelatinos.
Revenind la sfera neagră cu puncte albe, cristalele de NaCl coprecipitate pe AgS pot fi spălate cu apă distilată. Așa mai departe până când AgS este purificat, care poate fi apoi încălzit pentru a evapora toată apa.
Aplicații
Care sunt aplicațiile co-precipitațiilor? Unele dintre ele sunt următoarele:
-Permite cuantificarea substanțelor solubile care nu sunt ușor precipitate din mediu. Astfel, printr-un suport insolubil, transportă, de exemplu, izotopi radioactivi, cum ar fi franciul, pentru studii și analize ulterioare..
-Prin co-precipitarea ionilor în solide gelatinoase, purificați mediul lichid. Ocluzia este și mai de dorit în aceste cazuri, deoarece impuritatea nu va putea scăpa în exterior.
-Coprecipitarea face posibilă încorporarea substanțelor în solide în timpul formării lor. Dacă solidul este un polimer, atunci va absorbi substanțele dizolvate solubile care vor co-precipita în interior, oferindu-i noi proprietăți. Dacă este celuloză, de exemplu, cobaltul (sau alt metal) ar putea fi co-precipitat în interiorul acestuia.
-Pe lângă toate cele de mai sus, coprecipitarea este una dintre metodele cheie pentru sinteza nanoparticulelor pe un suport insolubil. Datorită acestui fapt, bionanomaterialele și nanoparticulele magnetite au fost sintetizate, printre multe altele..
Referințe
- Day, R. și Underwood, A. (1986). Chimie analitică cantitativă (ediția a cincea). PEARSON Prentice Hall.
- Wikipedia. (2018). Coprecipitare. Recuperat de pe: en.wikipedia.org
- NPTEL. (s.f.). Precipitații și co-precipitații. Recuperat de la: nptel.ac.in
- Înțelept Geek. (2018). Ce este Coprecipitarea. Recuperat de pe: wisegeek.com
- Wilson Sacchi Peternele, Victoria Monge Fuentes, Maria Luiza Fascineli și colab. (2014). Investigație experimentală a metodei de coprecipitare: o abordare pentru a obține nanoparticule de magnetit și maghemit cu proprietăți îmbunătățite. Jurnalul nanomaterialelor, vol. 2014, ID articol 682985, 10 pagini.



Nimeni nu a comentat acest articol încă.