
Mecanisme de coroziune galvanice, exemple, protecție
coroziune galvanică sau electrochimică Este un proces prin care un metal sau aliaj se degradează mai rapid în comparație cu oxidarea sa convențională. Se poate spune că este o oxidare accelerată și chiar propițiată intenționat; așa cum se întâmplă în celule sau baterii.
Acest lucru are loc în mai multe condiții. În primul rând, trebuie să existe un metal activ, numit anod. De asemenea, și în al doilea rând, trebuie să existe un metal nobil cu reactivitate redusă numit catod. A treia și a patra condiție sunt prezența unui mediu în care se propagă electroni, cum ar fi apa, și specii ionice sau electroliți..

Coroziunea galvanică este observabilă în special în mediile marine sau pe malul plajelor. Curenții de aer ridică mase de vapori de apă, care la rândul lor transportă niște ioni; acestea din urmă ajung să adere la un strat subțire de apă sau picături care se sprijină pe suprafața metalică.
Aceste condiții de umiditate și salinitate favorizează coroziunea metalului. Adică, o coroană de fier ca cea din imaginea de mai sus va rugini mai repede dacă este expusă în vecinătatea mării..
Ușurința pe care un metal va trebui să o oxideze în comparație cu un altul poate fi măsurată cantitativ prin potențialele sale de reducere; cărțile de chimie abundă în tabele cu aceste potențiale E. Cu cât este mai negativ, cu atât este mai mare înclinația sa spre rugină.
La fel, dacă acest metal este în prezența altui cu un potențial de reducere foarte pozitiv, având astfel un ΔE mare, oxidarea metalului reactiv va fi mai agresivă. Alți factori, cum ar fi pH-ul, puterea ionică, umiditatea, prezența oxigenului și relația dintre zonele metalului oxidat și cel redus, sunt de asemenea importante..
Indice articol
- 1 Mecanisme
- 1.1 Concepte și reacții
- 1.2 Depolarizatori
- 1.3 Coroziunea fierului
- 2 Exemple
- 2.1 Indici anodici
- 3 Protecție împotriva coroziunii electrochimice
- 3.1 Acoperiri de sacrificiu
- 3.2 Acoperiri nobile
- 4 Experiment pentru copii
- 4.1 Placă de fier în soluție de săruri de cupru
- 4.2 Curățarea oxidului de argint
- 5 Referințe
Mecanisme
Concepte și reacții
Înainte de a aborda mecanismele din spatele coroziunii galvanice, anumite concepte ar trebui clarificate.
Într-o reacție redox, o specie pierde electroni (se oxidează) în timp ce alta îi câștigă (reduce). Electrodul pe care se produce oxidarea se numește anod; și pe care are loc reducerea, catod (în engleză regula mnemonică Redcat a ține minte).
Astfel, pentru un electrod (o piesă, șurub etc.) a unui metal M, dacă se oxidează, se spune că este anodul:
M => Mn+ + ne-
Numărul de electroni eliberați va fi egal cu magnitudinea sarcinii pozitive a cationului Mn+ rezultând.
Apoi, un alt electrod sau metal R (ambele metale trebuie să fie în contact într-un fel), primește electronii eliberați; dar aceasta nu suferă o reacție chimică dacă câștigă electroni, deoarece îi va conduce doar (curent electric).
Prin urmare, trebuie să existe o altă specie în soluție care să poată accepta în mod formal acești electroni; ca ioni metalici ușor de redus, de exemplu:
Rn+ + ne- => R
Adică s-ar forma un strat de metal R și, prin urmare, electrodul ar deveni mai greu; în timp ce metalul M ar pierde masa din cauza dizolvării atomilor săi.
Depolarizatoare
Ce se întâmplă dacă nu ar exista cationi metalici care ar putea fi reduși suficient de ușor? În acest caz, alte specii prezente în mediu vor prelua electronii: depolarizatorii. Acestea sunt strâns legate de pH: ODouă, H+, Oh- si HDouăSAU.
Oxigenul și apa câștigă electroni într-o reacție exprimată prin următoarea ecuație chimică:
SAUDouă + 2HDouăO + 4e- => 4OH-
În timp ce ionii H+ transformă în HDouă:
2H+ + 2e- => HDouă
Adică specia OH- si HDouă sunt produse obișnuite ale coroziunii galvanice sau electrochimice.
Chiar dacă metalul R nu participă la nicio reacție, faptul că este mai nobil decât M favorizează oxidarea acestuia; și, în consecință, va exista o producție mai mare de ioni OH- sau hidrogen gazos. Pentru că, la urma urmei, este diferența dintre potențialele de reducere, ΔE, unul dintre principalii factori motori ai acestor procese.
Coroziunea fierului
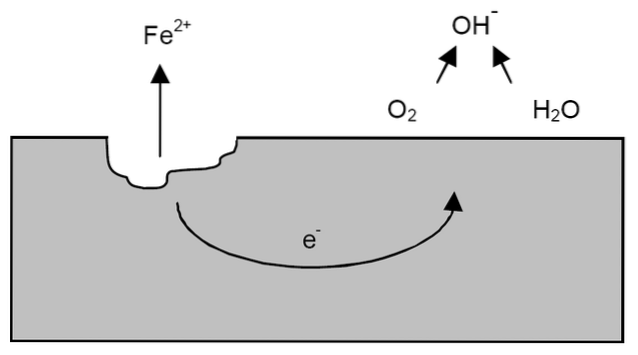
După clarificările anterioare, exemplul coroziunii fierului poate fi abordat (imaginea de sus). Să presupunem că există un strat subțire de apă în care oxigenul se dizolvă. Fără prezența altor metale, depolarizatorii vor stabili liniile directoare pentru reacție.
Astfel, fierul va pierde niște atomi de la suprafața sa pentru a se dizolva în apă ca cationi Fe.Două+:
Faith => FaithDouă+ + 2e-
Cei doi electroni vor călători prin bucata de fier, deoarece este un bun conductor de electricitate. Deci, unde este cunoscută oxidarea sau locul anodului, dar nu unde va continua reducerea sau localizarea sitului catodic. Situl catodului poate fi oriunde; și cu cât suprafața sa este mai mare, cu atât metalul se va coroda mai rău.
Să presupunem că electronii ajung la un punct așa cum se arată în imaginea de mai sus. Acolo atât oxigenul, cât și apa suferă reacția deja descrisă, prin care se eliberează OH-. Acești anioni OH- poate reacționa cu FeDouă+ a forma Fe (OH)Două, care precipită și suferă oxidări ulterioare care îl transformă în cele din urmă în rugină.
Între timp, site-ul anodului crăpă din ce în ce mai mult.
Exemple
În viața de zi cu zi exemplele de coroziune galvanică sunt numeroase. Nu trebuie să ne referim la coroana de fier: orice artefact din metale poate suferi același proces în prezența mediilor umede și sărate.
Pe lângă plajă, iarna poate oferi și condiții ideale pentru coroziune; de exemplu, atunci când împingeți săruri în zăpadă pe drum pentru a preveni deraparea mașinilor.
Din punct de vedere fizic, umezeala poate fi reținută în îmbinările sudate a două metale, fiind locuri active de coroziune. Acest lucru se datorează faptului că ambele metale se comportă ca doi electrozi, iar cel mai reactiv își va pierde electronii..
Dacă producția de ioni OH- Este considerabil, poate chiar coroda vopseaua mașinii sau a dispozitivului în cauză.
Indici anodici
Se pot construi propriile exemple de coroziune galvanică folosind tabelele cu potențial de reducere. Cu toate acestea, tabelul indexului anodic (simplificat în sine) va fi ales pentru a ilustra acest punct..
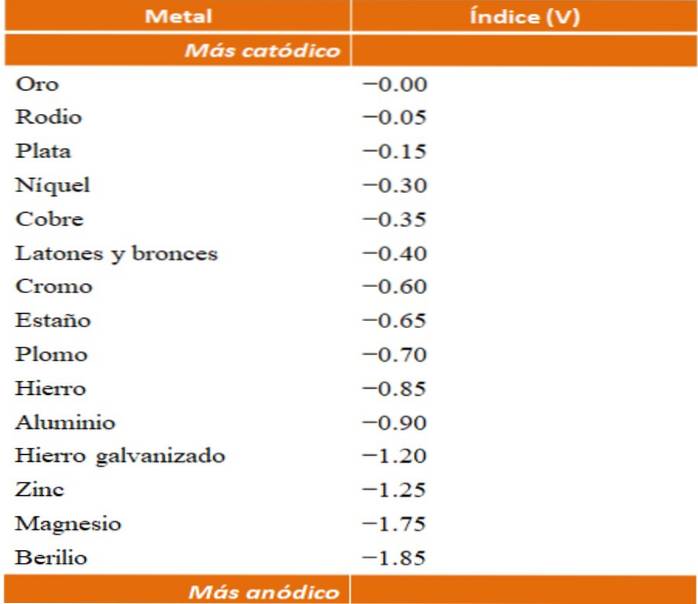
Să presupunem, de exemplu, că am vrut să construim o celulă electrochimică. Metalele care se află în partea de sus a tabelului indexului anodic sunt mai catodice; adică sunt ușor de redus și, prin urmare, va fi dificil să le aveți în soluție. În timp ce metalele aflate în partea de jos sunt mai anodice sau mai reactive și se corodează ușor.
Dacă alegem aurul și beriliul, ambele metale nu ar putea fi împreună mult timp, deoarece beriliu s-ar oxida extrem de repede..
Și dacă, pe de altă parte, avem o soluție de ioni Ag+ și scufundăm o bară de aluminiu în ea, aceasta se va dizolva în același timp în care precipită particule metalice de argint. Dacă această bară ar fi conectată la un electrod de grafit, electronii s-ar deplasa spre el pentru a depune electrochimic argint pe el sub formă de film de argint..
Și dacă în locul barei de aluminiu ar fi din cupru, soluția ar deveni albăstruie datorită prezenței ionilor de Cu.Două+ in apa.
Protecție electrochimică împotriva coroziunii
Acoperiri sacrificiale
Să presupunem că doriți să protejați o placă de zinc de coroziune în prezența altor metale. Cea mai simplă opțiune ar fi adăugarea de magneziu, care ar acoperi zincul astfel încât, odată oxidați, electronii eliberați din magneziu să reducă cationii Zn.Două+ înapoi.
Cu toate acestea, pelicula de MgO pe zinc ar sfârși prin a crapa mai devreme decât mai târziu, oferind site-uri anodice cu densitate mare de curent; adică coroziunea zincului ar accelera brusc chiar în acele puncte.
Această tehnică electrochimică de protecție împotriva coroziunii este cunoscută sub numele de utilizarea acoperirilor de sacrificiu. Cel mai cunoscut este zincul, folosit în celebra tehnică numită galvanizare. În ele, metalul M, în special fierul, este acoperit cu zinc (Fe / Zn).
Din nou, zincul se oxidează și oxidul său servește pentru a acoperi fierul și a transmite către el electroni care reduc FeDouă+ care se poate forma.
Acoperiri nobile
Să presupunem din nou că doriți să protejați aceeași foaie de zinc, dar acum veți folosi crom în loc de magneziu. Cromul este mai nobil (mai catodic, vezi tabelul cu indici anodici) decât zincul și, prin urmare, funcționează ca un strat nobil.
Problema cu acest tip de acoperire este că, odată cu crăparea, va promova și accelera oxidarea metalului de dedesubt; în acest caz, zincul ar coroda chiar mai mult decât să fie acoperit cu magneziu.
Și, în cele din urmă, există și alte acoperiri care constau din vopsele, materiale plastice, antioxidanți, grăsimi, rășini etc..
Experiment pentru copii
Placă de fier în dizolvarea sărurilor de cupru
Un experiment simplu poate fi conceput din același tabel de indici anodici. Dizolvarea unei cantități rezonabile (mai puțin de 10 grame) de CuSO45HDouăSau în apă, unui copil i se cere să se scufunde într-o placă de fier lustruită. Se face o fotografie și se permite desfășurarea procesului timp de câteva săptămâni.
Soluția este inițial albăstruie, dar va începe să se estompeze în timp ce placa de fier capătă o culoare arămie. Acest lucru se datorează faptului că cuprul este mai nobil decât fierul și, prin urmare, cationii săi CuDouă+ Acestea vor fi reduse la cupru metalic de la ionii dați de oxidarea fierului:
Faith => FaithDouă+ + 2e-
CuDouă+ + 2e- => Cu
Curățarea oxidului de argint
Obiectele de argint se înnegresc în timp, mai ales dacă sunt în contact cu o sursă de compuși de sulf. Rugina sa poate fi îndepărtată prin scufundarea obiectului într-o cadă cu apă cu bicarbonat de sodiu și folie de aluminiu. Bicarbonatul furnizează electroliții care vor facilita transportul de electroni între obiect și aluminiu.
Drept urmare, copilul va aprecia că obiectul își pierde petele negre și va străluci cu culoarea sa argintie caracteristică; în timp ce folia de aluminiu se va coroda pentru a dispărea.
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Wikipedia. (2019). Coroziune galvanica. Recuperat de pe: en.wikipedia.org
- Stephen Lower. (16 iunie 2019). Coroziune electrochimică. Chimie LibreTexte. Recuperat de pe: chem.libretexts.org
- Universitatea Deschisă. (2018). 2.4 Procese de coroziune: coroziune galvanică. Recuperat de la: open.edu
- Serviciul tehnic pentru clienți Brush Wellman Inc. (s.f.). Un ghid pentru coroziunea galvanică. Perie Wellman Engineered Materials.
- Giorgio Carboni. (1998). Experimente în electrochimie. Recuperat de pe: funsci.com



Nimeni nu a comentat acest articol încă.