
Proprietăți, riscuri și utilizări ale cromatului de potasiu (K2CrO4)
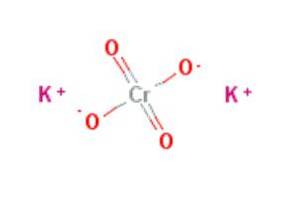
cromat de potasiu este un compus anorganic cu formula KDouăCrO4, caracterizat prin faptul că este un puternic agent oxidant. Se prepară prin tratarea dicromatului de potasiu cu hidroxid de potasiu conform reacției: KDouăCrO7 + 2KOH → 2KDouăCrO4 + HDouăSAU.
Ca un compus cu un profil relativ unic, cromatul de potasiu are o serie de utilizări în contexte industriale și științifice. Cu toate acestea, datorită toxicității sale, expunerea sa ar trebui să fie limitată (JACOBS, 2015).
Indice articol
- 1 Proprietăți fizice și chimice
- 2 Reactivitate și pericole
- 3 utilizări
- 4 Referințe
Proprietati fizice si chimice
Cromatul de potasiu sunt cristale ortorombice de culoare gălbuie, care nu au o aromă caracteristică și au un gust amar neplăcut (Centrul Național pentru Informații despre Biotehnologie, 2017).

Greutatea sa moleculară este de 194,19 g / mol, iar densitatea sa este de 2,7320 g / ml. Are un punct de topire de 968 ° C și un punct de fierbere de 1000 ° C.
Compusul este insolubil în alcool și foarte solubil în apă, fiind capabil să dizolve 62,9 grame la 100 ml de solvent la 20 ° C (Royal Society of Chemistry, 2015).
Reactivitate și pericole
Agenții oxidanți, cum ar fi cromatul de potasiu, pot reacționa cu agenții reducători pentru a genera căldură și produse care pot fi gazoase (provocând presurizarea recipientelor închise).
Produsele pot fi capabile de reacții suplimentare (cum ar fi combustia în aer). Reducerea chimică a materialelor din acest grup poate fi rapidă sau chiar explozivă, dar deseori necesită inițiere (căldură, scânteie, catalizator, adăugarea unui solvent).
Amestecurile explozive de agenți oxidanți anorganici cu agenți reducători rămân adesea neschimbate pentru perioade lungi de timp dacă se evită inițierea. Astfel de sisteme sunt de obicei amestecuri de solide, dar pot implica orice combinație de stări fizice. Unii agenți de oxidare anorganici sunt săruri metalice solubile în apă..
Dizolvarea scade, dar nu anulează puterea de oxidare a acestor materiale. Compușii organici, în general, au o anumită putere reducătoare și, în principiu, pot reacționa cu compușii din această clasă.
Reactivitatea efectivă variază foarte mult în funcție de identitatea compusului organic. Agenții oxidanți anorganici pot reacționa violent cu metale active, cianuri, esteri și tiocianați.
Compusul reprezintă o amenințare pentru mediu. Trebuie luate măsuri imediate pentru a-i limita răspândirea. Atunci când este utilizat oriunde, în orice scop, cromatul de potasiu necesită o izolare și o eliminare eficiente pentru a preveni orice scurgeri sau scurgeri în mediu..
În plus, cromatul de potasiu are capacitatea de a crește intensitatea unui incendiu dacă substanța chimică intră în contact cu materiale combustibile. Compusul emite vapori toxici de crom atunci când este încălzit (POTASSIUM CHROMATE, 2016).
Cromatul de potasiu este foarte coroziv și este un agent oxidant puternic. Afectează în principal nasul, gâtul și plămânii, provocând ulcerații, dificultăți de respirație, bronșită, pneumonie și astm, dar poate afecta și tractul gastro-intestinal, ficatul, rinichii și sistemul imunitar..
Această substanță este un cancerigen cunoscut pentru om și este asociată cu un risc crescut de a dezvolta cancer pulmonar și cancer al cavității sinonazale (Potassium Chromate, 2016).
Natura sa inodoră devine problematică când a fost expusă la această substanță chimică datorită toxicității sale. În multe cazuri, este posibil să nu știți că ați inhalat cromat de potasiu..
În plus, inhalarea acestei substanțe chimice prezintă mai multe riscuri. Simptomele includ greață, vărsături, dureri abdominale, senzație de arsură, diaree, șoc sau colaps..
În cazul contactului cu ochii, lentilele de contact trebuie verificate și îndepărtate. Apoi, este necesar să spălați imediat ochii cu multă apă timp de cel puțin 15 minute cu apă rece.
În caz de contact cu pielea, zona afectată trebuie clătită imediat cu multă apă timp de cel puțin 15 minute, în timp ce îndepărtați hainele și încălțămintea contaminate. Acoperiți pielea iritată cu un emolient.
Spălați hainele și încălțămintea înainte de refolosire. Dacă contactul este sever, spălați cu un săpun dezinfectant și acoperiți pielea contaminată cu o cremă antibacteriană.
În caz de inhalare, victima trebuie mutată într-un loc răcoros. Dacă nu respirați, se administrează respirație artificială.
Dacă compusul este ingerat, vărsăturile nu trebuie induse decât dacă sunt instruite de personalul medical. Slăbiți îmbrăcămintea strânsă, cum ar fi gulerul, cămașa sau cravata cămășii.
În toate cazurile, trebuie acordată imediat asistență medicală (Fișa tehnică de siguranță a materialului Cromat de potasiu, 2013).
Aplicații
Cromatul de potasiu se bucură de o mare varietate de utilizări industriale. În industria textilă, producătorii folosesc cromat de potasiu pentru a bronza îmbrăcămintea și țesăturile din piele și vopsire (Dye, 2017).
De asemenea, funcționează ca agent oxidant în industrie și în sinteza organică. Este utilizat medical ca antiseptic extern sau astringent și este prezent în unele medicamente veterinare.
Cromatul de potasiu este utilizat ca indicator în determinarea clorurii prin titrare cu soluție standard de azotat de argint. Această metodă se numește metoda Mohr de determinare a clorurii..
Această metodă se bazează pe formarea unui precipitat de cromat de argint roșu la punctul final, după ce toată clorura a precipitat sub formă de clorură de argint alb..
O soluție de 5% de cromat de potasiu care a fost neutralizată cu clorură este frecvent utilizată. Aproximativ 1 mL din acest indicator trebuie utilizat la 100 mL de volum de probă (RICCA Chemical Company, 2015). Reacțiile pentru titrarea Mohr sunt:
Ag+ + Cl- → AgCl (precipitat alb)
2 Ag+ (exces) + CrO4Două- → AgDouăCrO4 (precipitat roșu la punctul final)
Referințe
- Dye, J. L. (2017, 1 martie). Potasiu (K) ELEMENT CHIMIC. Recuperat din enciclopedia britannica.com.
- JACOBS, J. (2015, 3 august). Pentru ce se folosește cromatul de potasiu? Recuperat de la livestrong.com.
- Fișă tehnică de siguranță a materialului Cromat de potasiu. (2013, 21 mai). Recuperat de la sciencelab.com.
- Centrul Național pentru Informații despre Biotehnologie. (2017, 4 martie). Baza de date compusă PubChem; CID = 24597. Adus de la PubChem.
- Cromat de potasiu. (2016, 27 februarie). Recuperat de la NCIt.
- CROMAT DE POTASIU. (2016). Recuperat din cameochemicals.
- RICCA Chemical Company. (2015). cromat de potasiu. Recuperat de la riccachemical.
- Societatea Regală de Chimie. (2015). Cromat de potasiu. Recuperat de la chemspider.com.


Nimeni nu a comentat acest articol încă.