
Proprietăți, utilizări și exemple ale derivatelor halogenate

derivați halogenați sunt toți acei compuși care au un atom de halogen; adică oricare dintre elementele grupului 17 (F, Cl, Br, I). Aceste elemente diferă de restul prin faptul că sunt mai electronegative, formând o diversitate de halogenuri anorganice și organice..
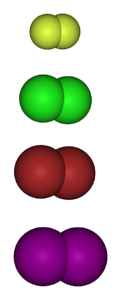
Imaginea de mai jos prezintă moleculele gazoase ale halogenilor. De sus în jos: fluor (FDouă), clor (ClDouă), brom (BrDouă) și iod (IDouă). Fiecare dintre acestea are capacitatea de a reacționa cu marea majoritate a elementelor, chiar și între congeneri din același grup (interhalogeni).
Astfel, derivații halogenați au formula MX dacă este o halogenură metalică, RX dacă este alchil și ArX dacă este aromatic. Ultimele două sunt în categoria halogenurilor organice. Stabilitatea acestor compuși necesită un „beneficiu” energetic în comparație cu molecula de gaz originală.
Ca regulă generală, fluorul formează derivați halogenați mai stabili decât iodul. Motivul se datorează diferențelor dintre razele lor atomice (sferele mov sunt mai voluminoase decât cele galbene).
Pe măsură ce raza atomică crește, suprapunerea orbitalelor dintre halogen și celălalt atom este mai slabă și, prin urmare, legătura este mai slabă..
Indice articol
- 1 Nomenclatură
- 1.1 Anorganice
- 1.2 Organic
- 2 Proprietăți
- 2.1 Halogenuri anorganice
- 2.2 Halogenuri organice
- 3 utilizări
- 4 Exemple suplimentare
- 5 Referințe
Nomenclatură
Modul corect de denumire a acestor compuși depinde dacă sunt anorganici sau organici..
Anorganic
Halogenurile metalice constau dintr-o legătură, ionică sau covalentă, între un halogen X și un metal M (din grupele 1 și 2, metale de tranziție, metale grele etc.).
În acești compuși toți halogenii au o stare de oxidare de -1. De ce? Deoarece setările sale de valență sunt nsDouănp5.
Prin urmare, trebuie să câștige un singur electron pentru a completa octetul de valență, în timp ce metalele se oxidează, oferindu-le electronii de care dispun..
Astfel, fluorul rămâne ca F-, fluor; Cl-, clorură; BR-, bromură; iar eu-, Durez. MF s-ar numi: (denumirea metalului) fluorură (n), unde n este valența metalului numai atunci când are mai mult de unul. Pentru cazul metalelor din grupele 1 și 2, nu este necesar să se numească valența.
Exemple
- NaF: fluorură de sodiu.
- CaClDouă: clorura de calciu.
- AgBr: bromură de argint.
- ZnIDouă: iodură de zinc.
- CuCl: clorură de cupru (I).
- CuClDouă: clorură de cupru (II).
- TiCl4: clorură de titan (IV) sau tetraclorură de titan.
Cu toate acestea, hidrogenul și elementele nemetalice - chiar și halogenii înșiși - pot forma și halogenuri. În aceste cazuri, valența nemetalului nu este denumită la sfârșit:
- PCl5: pentaclorură de fosfor.
- BF3: trifluorură de bor.
- Ali3: triiodură de aluminiu.
- HBr: bromură de hidrogen.
- DACĂ7: heptafluorură de iod.
Organic
Indiferent dacă este RX sau ArX, halogenul este legat covalent de un atom de carbon. În aceste cazuri, halogenii sunt menționați prin numele lor, iar restul nomenclaturii depinde de structura moleculară a lui R sau Ar.
Pentru cea mai simplă moleculă organică, metanul (CH4), următorii derivați se obțin prin substituirea lui H cu Cl:
- CH3Cl: clorometan.
- CHDouăClDouă: diclormetan.
- CHCI3: triclorometan (cloroform).
- CCl4: tetraclorometan (clorură de carbon (IV) sau tetraclorură de carbon).
Aici R constă dintr-un singur atom de carbon. Deci, pentru alte lanțuri alifatice (liniare sau ramificate) se numără numărul de atomi de carbon din care este legat de halogen:
CH3CHDouăCHDouăF: 1-fluoropropan.
Exemplul de mai sus a fost cel al unei halogenuri de alchil primare. În cazul în care lanțul este ramificat, se alege cel mai lung lanț care conține halogen și începe numărarea, lăsând cel mai mic număr posibil:
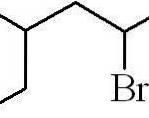
3-metil-5-bromohexan
La fel se întâmplă și pentru alți substituenți. La fel, pentru halogenurile aromatice se numește halogenul și apoi restul structurii:
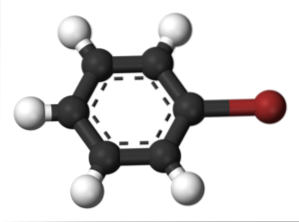
Imaginea superioară arată compusul numit bromobenzen, evidențiind atomul de brom în maro.
Proprietăți
Halogenuri anorganice
Halogenurile anorganice sunt solide ionice sau moleculare, deși primele sunt mai abundente. În funcție de interacțiunile și razele ionice ale MX, acesta va fi solubil în apă sau în alți solvenți mai puțin polari.
Halogenurile nemetalice (cum ar fi halogenurile de bor) sunt în general acizi Lewis, ceea ce înseamnă că acceptă electroni pentru a forma complexe. Pe de altă parte, halogenurile de hidrogen (sau halogenurile) dizolvate în apă produc ceea ce sunt cunoscute sub numele de hidrați..
Punctele sale de topire, fierbere sau sublimare cad pe interacțiunile electrostatice sau covalente dintre metal sau nemetal cu halogenul..
De asemenea, razele ionice joacă un rol important în aceste proprietăți. De exemplu, dacă M+ și X- au dimensiuni similare, cristalele tale vor fi mai stabile.
Halogenuri organice
Sunt polari. De ce? Deoarece diferența de electronegativități între C și halogen creează un moment polar permanent în moleculă. La fel, acest lucru scade pe măsură ce grupul 17 coboară, de la legătura C-F la C-I.
Indiferent de structura moleculară a lui R sau Ar, numărul crescând de halogeni afectează direct punctele de fierbere, deoarece acestea măresc masa molară și interacțiunile intermoleculare (RC-X-X-CR). Majoritatea sunt nemiscibile cu apa, dar se pot dizolva în solvenți organici.
Aplicații
Utilizările derivaților halogenați își pot rezerva propriul text. „Partenerii” moleculari ai halogenilor sunt un factor cheie, deoarece proprietățile și reactivitățile lor definesc utilizările derivatului..
Astfel, printre marea diversitate de utilizări posibile, se remarcă următoarele:
- Halogenii moleculari sunt utilizați pentru a crea becuri cu halogen, unde intră în contact cu filamentul de tungsten incandescent. Scopul acestui amestec este de a reacționa halogenul X cu tungstenul evaporat. În acest fel, se evită depunerea sa pe suprafața becului, garantând o durată de viață mai lungă..
- Sărurile de fluor sunt utilizate în fluorizarea apei și a pastelor de dinți.
- Hipocloritii de sodiu și de calciu sunt doi agenți activi în soluțiile de albire comerciale (clor)..
- Deși afectează stratul de ozon, clorofluorocarburile (CFC) sunt utilizate în aerosoli și sisteme de refrigerare..
- Clorură de vinil (CHDouă= CHCl) este monomerul polimerului de clorură de polivinil (PVC). Pe de altă parte, teflonul, utilizat ca material antiaderent, constă din lanțuri polimerice de tetrafluoretilenă (FDouăC = CFDouă).
- Acestea sunt utilizate în chimia analitică și în sinteze organice în diferite scopuri; printre acestea, sinteza medicamentelor.
Exemple suplimentare
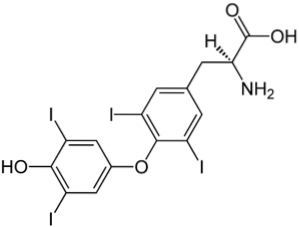
Imaginea superioară ilustrează hormonul tiroidian, responsabil pentru producerea căldurii, precum și pentru creșterea metabolismului general din organism. Acest compus este un exemplu de derivat halogenat prezent în corpul uman.
Printre alți compuși halogenați sunt menționați:
- Diclorodifeniltricloretan (DDT), insecticid eficient, dar cu efecte grave asupra mediului.
- Clorură de staniu (SnClDouă), utilizat ca agent de reducere.
- Cloroetan sau 1-cloroetan (CH3CHDouăCl), un anestezic topic care acționează rapid prin răcirea pielii.
- Dicloretilenă (ClCH = CClH) și tetracloretilenă (ClDouăC = CClDouă), utilizat ca solvenți în industria de curățătorie chimică.
Referințe
- Dr. Ian Hunt. Nomenclatura organică IUPAC de bază Halaloani / halogenuri de alchil. Adus pe 04 mai 2018, de pe: chem.ucalgary.ca
- Richard C. Banks. (August 2000). Nomenclatura halogenurilor organice. Adus pe 04 mai 2018, de pe: chemistry.boisestate.edu
- Advameg, Inc. (2018). Compuși organici halogeni. Adus pe 4 mai 2018, de pe: chemistryexplained.com
- Compuși organici halogeni. Adus pe 04 mai 2018, de la: 4college.co.uk
- Dr. Seham Alterary. (2014). Compuși organici halogeni. Adus pe 04 mai 2018, de pe: fac.ksu.edu.sa
- Clark J. Proprietățile fizice ale halogenurilor de alchil. Adus pe 04 mai 2018, de pe: chem.libretexts.org
- Dr. Manal K. Rasheed. Halogenuri organice. Adus pe 4 mai 2018, de pe: comed.uobaghdad.edu.iq



Nimeni nu a comentat acest articol încă.