
Structura, proprietățile, utilizările dodecil sulfatului de sodiu (SDS)
dodecil sulfat de sodiu (SDS), este o sare organică anionică, sintetică și amfiphilică. Partea apolară și hidrofobă corespunde lanțului de hidrocarburi; în timp ce partea polară și hidrofilă se datorează sulfatului, cu o sarcină negativă.
SDS este un agent tensioactiv: moleculele sale sunt plasate pe suprafața soluțiilor apoase, producând o scădere a tensiunii superficiale. Această caracteristică îi permite să fie utilizată în șampon, paste de dinți, săpunuri și alte articole de îngrijire personală și de curățare de uz casnic..
Dodecil sulfatul de sodiu se leagă de proteină și produce desfășurarea acesteia, dobândind o formă alungită. Grupurile sulfatate sunt expuse la apă, dobândind sarcini negative, al căror număr este proporțional cu greutatea lor moleculară..
Din acest motiv, SDS permite determinarea greutăților moleculare ale proteinelor prin electroforeză cu poliacrilamidă..
Deși a fost suspectat un posibil efect cancerigen al SDS, nu sa demonstrat în mod concludent că este așa. SDS poate provoca iritarea pielii și a ochilor ca și alți detergenți..
Indice articol
- 1 Structura SDS
- 1.1 Cristale
- 1.2 Micele
- 2 Proprietăți
- 2.1 Denumiri
- 2.2 Formula moleculară
- 2.3 Masa molară
- 2.4 Descrierea fizică
- 2.5 Miros
- 2.6 Punct de topire
- 2.7 Solubilitatea în apă
- 2.8 Densitate
- 2.9 Stabilitate
- 2.10 Descompunerea
- 2.11 Tensiunea superficială
- 2.12 Concentrația molară critică
- 3 utilizări
- 3.1 Îngrijire personală și curățenie acasă
- 3.2 Medicină veterinară și umană
- 3.3 În laborator
- 3.4 Aditiv alimentar
- 3.5 Industrie
- 4 Riscuri
- 5 Referințe
Structura SDS
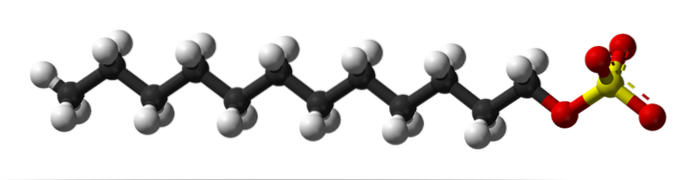
În prima imagine, molecula SDS a fost prezentată cu un model de sfere și tije. După cum se poate observa, are o coadă carbogazoasă hidrofobă și nepolare (sfere alb-negru); și în același timp, un cap polar, grație prezenței grupului -SO4- (sfere galbene și roșii).
Deși nu este afișat, ar trebui să existe o sferă purpurie care să reprezinte cationul Na+, chiar lângă grupul -SO4-, interacționând electrostatic.
Acestea fiind spuse, este ușor de văzut de ce acest compus este amfiphilic; și, de asemenea, un agent tensioactiv anionic, deoarece sarcina SDS este negativă și poate atrage și alți cationi în plus față de Na+.
Molecula dă impresia falsă că este rigidă, o structură liniară imobilă. Cu toate acestea, este exact opusul. SDS ar putea fi comparat cu un „vierme”, a cărui coadă carbogazoasă prezintă multiple vibrații și rotații ale legăturilor sale unice. Acest lucru îl face capabil să adopte diferite forme sau pliuri în mijloc; în apă, de exemplu.
Cristale
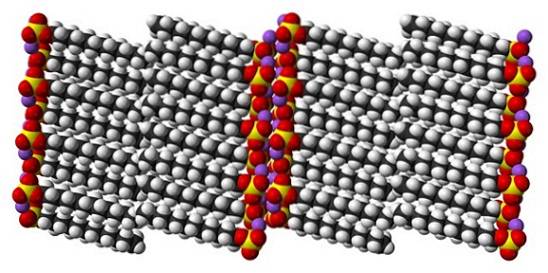
Deși este adevărat că dodecil sulfatul de sodiu este o moleculă dinamică, în stare solidă nu trebuie să se miște prea mult, comportându-se ca o tijă „simplă”. Și astfel, fiecare moleculă sau bară este poziționată în așa fel încât să crească interacțiunile dintre cozile de carbonat și, în același timp, cele ale încărcăturilor lor ionice..
Rezultatul este formarea unui cristal monoclinic, unde moleculele SDS sunt împachetate în mai multe coloane de bare (imaginea de sus). Forțele intermoleculare care le leagă sunt de așa natură încât aceste cristale necesită o temperatură de 206 ° C pentru a se topi în faza lichidă..
Micelles
În afara confortului cristalelor sale, molecula SDS nu mai poate sta liniștită; începe să-și răsucească coada pentru a crește sau a reduce interacțiunile cu mediul exterior.
Dacă acest mediu este apă, apare un fenomen numit formarea micelei: cozile carbogazoase și hidrofobe se unesc pentru a se înarma, în timp ce capetele polare, grupele -SO4-, rămân la suprafață interacționând cu moleculele H.DouăSAU.
Micela preia apoi o morfologie ellipsoidă oblată (ca Pământul, dar mai turtită). În sticlă sunt ca niște blocuri de bare și într-un mediu apos ca micelele elipsoide. Dacă mediul ar fi gras? Micela ar fi inversată: capetele polare SO4- ar merge la miez, în timp ce cozile lor carbogazoase ar fi expuse uleiului.
Proprietăți
Numele
- Dodecil sulfat de sodiu (SDS).
- Lauril sulfat de sodiu (SLS).
Formulă moleculară
C12H25SAU4SNa.
Masă molară
288,378 g / mol.
Descriere Fizica
Diverse prezentări: pulbere uscată, lichidă sau solidă umedă. Cristalele sale au o culoare albă sau cremoasă.
Miros
Miros slab al substanțelor grase, inodor.
Punct de topire
206 ºC.
Solubilitatea apei
1 105 mg / L. 1 g dizolvat în 10 ml de soluție opalescentă.
Densitate
1,01 g / cm3.
Stabilitate
Stabil în condițiile de depozitare recomandate.
Descompunere
Când este încălzit până la descompunere, emite un fum alb de oxid de sulf și oxid de sodiu.
Tensiune de suprafata
39,5 dynes / cm la 25 ° C.
Concentrația molară critică
Are 8,2 mM în apă pură la 25 ° C.
Aplicații
Ingrijire personala si curatenie la domiciliu
Dodecil sulfatul este un agent tensioactiv care este utilizat în multe produse, cum ar fi săpunurile pentru mâini, băile cu spumă, cremele de ras etc. Se mai folosește și pentru îndepărtarea petelor greu de îndepărtat de pe haine, curățarea podelelor și băilor, spălarea articolelor de bucătărie etc..
Medicină veterinară și umană
Este folosit ca un produs respingător pentru purici și căpușe, prezent la animale. Este, de asemenea, utilizat ca umectant în unele antibiotice, pentru uz oral sau topic..
SDS este microbicid împotriva virusurilor învelite, precum HIV, tipurile 1 și 2, și virusul herpes simplex (HSV-2). Acționează și asupra virușilor neînveliți: papilomavirus, reovirus, rotavirus și poliovirus. Cu toate acestea, această utilizare nu este aprobată..
Utilizarea SDS ca duș a fost sugerată pentru a oferi protecție împotriva virușilor cu transmitere sexuală. De asemenea, în procesarea laptelui matern pentru a elimina sau reduce posibilitatea transmiterii HIV prin alăptare.
În plus față de acțiunea sa antivirală, SDS acționează asupra bacteriilor și ciupercilor patogene. SDS elimină rezistența la medicamente și factorii de transfer sexual de la E. coli; și blochează creșterea numeroaselor bacterii Gram pozitive.
La laborator
SDS se leagă de proteine provocând denaturarea acestora, oferindu-le sarcini negative și o schimbare conformațională. Acest lucru permite determinarea greutăților lor moleculare prin electroforeză cu poliacrilamidă..
SDS este, de asemenea, utilizat la prepararea probelor de țesut cerebral pentru utilizare în microscopie cu lumină. Este, de asemenea, utilizat la prepararea probelor de sânge pentru numărarea numărului de eritrocite..
SDS este utilizat în purificarea acizilor nucleici, datorită capacității sale de a dizolva membranele și acțiunii sale inhibitoare asupra activității enzimelor RNase și DNase.
În plus, SDS este utilizat în caracterizarea compușilor de amoniu cuaternari..
Aditiv alimentar
SDS este utilizat ca emulgator și îngroșător în alimente. Îmbunătățește stabilitatea și textura produselor de patiserie. În plus, este utilizat ca un auxiliar pentru a bate produse din ouă uscate..
Industrie
SDS este utilizat în industria de galvanizare, în special nichel și zinc; ca emulgator și penetrant în lac și îndepărtarea vopselei; în formularea explozivilor turnați prin injecție; și în combustibilii solizi pentru rachete ca agent de spumare.
Riscuri
Expunerea constantă la SDS poate provoca hiperplazie cutanată la cobai. Iepurii și oamenii sunt mai puțin sensibili la aceste leziuni. Contactul direct cu SDS la o concentrație ≤ 20%, poate provoca inflamații moderate și iritații ale pielii.
Pe de altă parte, expunerea prelungită la SDS poate provoca dermatită, cu semne de roșeață, umflături și vezicule..
SDS poate provoca iritarea ochilor la contact. Poate fi, de asemenea, foarte reactiv la unele persoane, provocând iritații ale căilor respiratorii și stres respirator prin inhalare..
În cazuri rare, ingestia de SDS poate provoca leziuni caustice. Dar, a fost raportat la copiii care au ingerat SDS, dezvoltând rapid vărsături abundente, depresie SNC și suferință respiratorie..
Nu au fost găsite dovezi de genotoxicitate sau acțiune teratogenă în SDS. La 242 de pacienți cu dermatită eczematoasă, 6,4% dintre pacienți s-au dovedit a avea o alergie, atribuită utilizării SDS.
Referințe
- Date structurale de la L. A. Smith, R. B. Hammond, K. J. Roberts, D. Machin, G. McLeod (2000). Determinarea structurii cristaline a dodecil sulfatului de sodiu anhidru utilizând o combinație de difracție de pulbere de radiație sincrotronă și tehnici de modelare moleculară. Journal of Molecular Structure 554 (2-3): 173-182. DOI: 10.1016 / S0022-2860 (00) 00666-9.
- Wikipedia. (2019). Dodecil sulfat de sodiu. Recuperat de pe: en.wikipedia.org
- Centrul Național pentru Informații despre Biotehnologie. (2019). Dodecil sulfat de sodiu. Baza de date PubChem. CID = 3423265. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Hammouda B. (2013). Efectul temperaturii asupra nanostructurii micelelor SDS în apă. Jurnal de cercetare al Institutului Național de Standarde și Tehnologie, 118, 151-167. doi: 10.6028 / jres.118.008
- Elsevier. (2019). Dodecil sulfat de sodiu. Știință directă. Recuperat de pe: sciencedirect.com
- Kumar, S., Thejasenuo, J. K. și Tsipila, T. (2014). Efectele toxicologice ale dodecil sulfatului de sodiu. Journal of Chemical and Pharmaceutical Research 6 (5): 1488-1492.
- Rețea de date privind toxicologia. (s.f.). Laurilsulfat de sodiu. Toxnet. Recuperat de la: toxnet.nlm.nih.gov



Nimeni nu a comentat acest articol încă.