
Scale de electronegativitate, variație, utilitate și exemple

electronegativitate este o proprietate periodică relativă care se referă la capacitatea unui atom de a atrage densitatea electronilor din mediul său molecular. Este tendința unui atom de a atrage electroni atunci când este atașat la o moleculă. Acest lucru se reflectă în comportamentul multor compuși și în modul în care aceștia interacționează intermolecular între ei..
Nu toate elementele atrag electronii din atomii adiacenți în același grad. În cazul celor care dau densitate electronică cu ușurință, se spune că sunt electropozitiv, în timp ce cele care sunt „acoperite” cu electroni sunt electronegativ. Există multe modalități de a explica și observa această proprietate (sau concept).
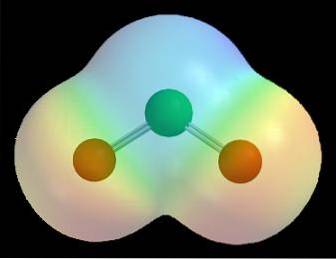
De exemplu, în hărțile de potențial electrostatic pentru o moleculă (cum ar fi cea pentru dioxidul de clor din imaginea de mai sus, ClODouă) se observă efectul diferitelor electronegativități pentru atomii de clor și oxigen.
Culoarea roșie indică regiunile moleculei bogate în electroni, δ-, iar culoarea albastră indică regiunile sărace în electroni, δ +. Astfel, după o serie de calcule de calcul, se poate stabili acest tip de hartă; mulți dintre ei prezintă o relație directă între localizarea atomilor electronegativi și δ-.
De asemenea, poate fi vizualizat după cum urmează: în cadrul unei molecule, tranzitul de electroni este mai probabil să aibă loc în vecinătatea celor mai electronici atomi. Din acest motiv, pentru ClODouă atomii de oxigen (sferele roșii) sunt înconjurați de un nor roșu, în timp ce atomul de clor (sfera verde) sunt înconjurați de un nor albăstrui.
Definiția electronegativității depinde de abordarea dată fenomenului, există mai multe scale care îl consideră din anumite aspecte. Cu toate acestea, toate scările au în comun faptul că sunt susținute de natura intrinsecă a atomilor.
Indice articol
- 1 Scale de electronegativitate
- 1.1 Scara Pauling
- 1.2 Scara Mulliken
- 1.3 Scara A.L. Allred și E. Rochow
- 2 Cum variază electronegativitatea pe tabelul periodic?
- 2.1 Atomul din moleculă
- 3 Pentru ce este?
- 4 Exemple (clor, oxigen, sodiu, fluor)
- 5 Referințe
Scale de electronegativitate
Electronegativitatea nu este o proprietate care poate fi cuantificată și nici nu are valori absolute. De ce? Deoarece tendința unui atom de a atrage densitatea electronilor spre acesta nu este aceeași în toți compușii. Cu alte cuvinte: electronegativitatea variază în funcție de moleculă.
Da pentru molecula ClODouă Dacă atomul de Cl ar fi schimbat cu atomul de N, atunci se va schimba și tendința lui O de a atrage electroni; ar putea crește (face norul mai roșu) sau scădea (pierde culoarea). Diferența ar consta în noua legătură N-O formată, pentru a avea astfel molecula O-N-O (dioxid de azot, NODouă).
Deoarece electronegativitatea unui atom nu este aceeași pentru toate împrejurimile sale moleculare, este necesar să-l definim în termeni de alte variabile. În acest fel, există valori care servesc drept referință și care permit prezicerea, de exemplu, a tipului de legătură care se formează (ionică sau covalentă).
Scală Pauling
Marele om de știință și câștigătorul a două premii Nobel, Linus Pauling, a propus în 1932 o formă cantitativă (măsurabilă) a electronegativului cunoscută sub numele de scara Pauling. În el, electronegativitatea a două elemente, A și B, formând legături, a fost legată de energia suplimentară asociată cu caracterul ionic al legăturii A-B.
Cum este aceasta? Teoretic, legăturile covalente sunt cele mai stabile, deoarece distribuția electronilor lor între doi atomi este echitabilă; adică pentru moleculele A-A și B-B ambii atomi împart perechea de electroni ai legăturii în același mod. Cu toate acestea, dacă A este mai electronegativ, atunci perechea respectivă va fi mai mult din A decât din B.
În acest caz, A-B nu mai este complet covalent, deși dacă electronegativitățile lor nu diferă prea mult, se poate spune că legătura lor are un caracter covalent ridicat. Când se întâmplă acest lucru, legătura suferă o instabilitate mică și capătă energie suplimentară ca produs al diferenței de electronegativitate între A și B.
Cu cât această diferență este mai mare, cu atât este mai mare energia legăturii A-B și, în consecință, cu atât este mai mare caracterul ionic al legăturii menționate..
Această scară reprezintă cea mai utilizată în chimie, iar valorile electronegativităților au apărut din atribuirea unei valori de 4 pentru atomul de fluor. De acolo, ei ar putea calcula cel al celorlalte elemente.
Scara Mulliken
În timp ce scara Pauling are legătură cu energia asociată legăturilor, scara Robert Mulliken este mai mult legată de alte două proprietăți periodice: energia de ionizare (EI) și afinitatea electronică (AE).
Astfel, un element cu valori ridicate ale EI și AE este foarte electronegativ și, prin urmare, va atrage electroni din mediul său molecular..
De ce? Deoarece EI reflectă cât de dificil este să „smulgem” un electron extern din acesta și AE cât de stabil este anionul format în faza gazoasă. Dacă ambele proprietăți au magnitudini mari, atunci elementul este „iubitor” de electroni..
Electronegativitățile Mulliken sunt calculate cu următoarea formulă:
ΧM = ½ (EI + AE)
Adică χM este egal cu valoarea medie a EI și AE.
Cu toate acestea, spre deosebire de scara Pauling care depinde de ce atomi formează legături, aceasta este legată de proprietățile stării de valență (cu cele mai stabile configurații electronice).
Ambele scale generează valori similare de electronegativitate pentru elemente și sunt aproximativ legate de următoarea reconversie:
ΧP = 1,35 (ΧM)1/2 - 1,37
Ambele XM ca XP sunt valori adimensionale; adică le lipsește unități.
Scara A.L. Allred și E. Rochow
Există și alte scale de electronegativitate, cum ar fi scalele Sanderson și Allen. Cu toate acestea, cea care urmează primelor două este scala Allred și Rochow (χAR). De data aceasta se bazează pe sarcina nucleară efectivă pe care o experimentează un electron la suprafața atomilor. Prin urmare, este direct legată de forța atractivă a nucleului și de efectul ecranului..
Cum variază electronegativitatea pe tabelul periodic?
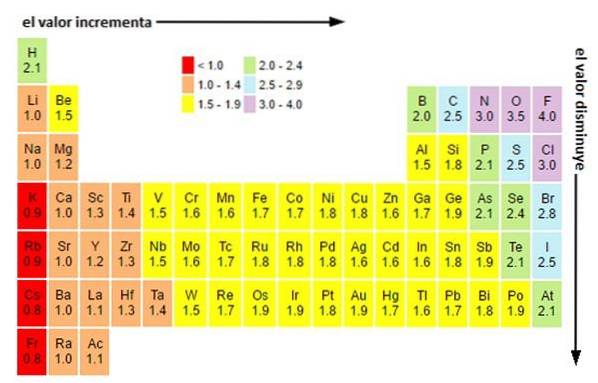
Indiferent de scale sau valorile pe care le aveți, electronegativitatea crește de la dreapta la stânga pentru o perioadă și de jos în sus în grupuri. Astfel, crește spre diagonala din dreapta sus (fără a lua în considerare heliul) până când întâlnește fluor.
În imaginea de mai sus puteți vedea ceea ce tocmai a fost spus. În tabelul periodic, electronegativitățile Pauling sunt exprimate în funcție de culorile celulelor. Deoarece fluorul este cel mai electronegativ, acesta are o culoare violetă mai proeminentă, în timp ce cele mai puțin electronegative (sau electropozitive) culori mai închise..
La fel, se poate observa că capetele grupurilor (H, Be, B, C etc.) au culori mai deschise și că pe măsură ce unul coboară prin grup, celelalte elemente se întunecă. Despre ce este vorba? Răspunsul este din nou atât în proprietățile EI, AE, Zef (sarcină nucleară efectivă), cât și în raza atomică.
Atomul din moleculă
Atomii individuali au o sarcină nucleară reală Z și electronii externi suferă o sarcină nucleară eficientă ca urmare a efectului de protecție..
Pe măsură ce se mișcă într-o perioadă, Zef crește în așa fel încât atomul să se contracte; adică razele atomice sunt reduse într-o perioadă.
Aceasta are consecința că, în momentul legării unui atom cu altul, electronii vor „curge” către atomul cu cel mai mare Zef. De asemenea, acest lucru conferă un caracter ionic legăturii dacă există o tendință marcată ca electronii să meargă spre un atom. Când acest lucru nu este cazul, atunci vorbim de o legătură predominant covalentă.
Din acest motiv, electronegativitatea variază în funcție de razele atomice, Zef, care la rândul lor sunt strâns legate de EI și AE. Totul este un lanț.
Pentru ce este?
Pentru ce este electronegativitatea? În principiu, pentru a determina dacă un compus binar este covalent sau ionic. Când diferența de electronegativitate este foarte mare (cu o rată de 1,7 unități sau mai mult) se spune că compusul este ionic. De asemenea, este util să discernem într-o structură care regiuni sunt susceptibile de a fi mai bogate în electroni..
De aici, ce mecanism sau reacție poate suferi compusul poate fi prezis. În regiunile sărace în electroni, δ +, speciile încărcate negativ pot acționa într-un anumit mod; și în regiunile bogate în electroni, atomii lor pot interacționa în moduri foarte specifice cu alte molecule (interacțiuni dipol-dipol).
Exemple (clor, oxigen, sodiu, fluor)
Care sunt valorile electronegativității pentru atomii de clor, oxigen, sodiu și fluor? După fluor, cine este cel mai electronegativ? Folosind tabelul periodic, se observă că sodiul are o culoare violet închis, în timp ce culorile pentru oxigen și clor sunt vizual foarte asemănătoare..
Valorile sale de electronegativitate pentru scările Pauling, Mulliken și Allred-Rochow sunt:
Na (0,93, 1,21, 1,01).
Sau (3.44, 3.22, 3.50).
Cl (3,16, 3,54, 2,83).
F (3,98, 4,43, 4,10).
Rețineți că, cu valorile numerice, se observă o diferență între negativitățile oxigenului și clorului.
Conform scalei Mulliken, clorul este mai electronegativ decât oxigenul, spre deosebire de scale Pauling și Allred-Rochow. Diferența de electronegativitate dintre cele două elemente este și mai evidentă folosind scara Allred-Rochow. Și, în cele din urmă, fluorul, indiferent de scara aleasă, este cel mai electronegativ..
Prin urmare, acolo unde există un atom F într-o moleculă înseamnă că legătura va avea un caracter ionic ridicat..
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (Ediția a patra., Paginile 30 și 44). Mc Graw Hill.
- Jim Clark. (2000). Electronegativitate. Luat de la: chemguide.co.uk
- Dr. Anne Marie Helmenstine (11 decembrie 2017). Definiție și exemple de electronegativitate. Luat de pe: thoughtco.com
- Mark E. Tuckerman. (5 noiembrie 2011). Scara de electronegativitate. Luat din: nyu.edu
- Wikipedia. (2018). Electronegativitate. Luat de pe: es.wikipedia.org



Nimeni nu a comentat acest articol încă.