
Link Pi Cum este format, caracteristici și exemple
A pi link (π) este un tip de legătură covalentă caracterizat prin prevenirea mișcării libere de rotație a atomilor și prin originarea între o pereche de orbitați atomici de tip pur, printre alte particularități. Există legături care se pot forma între atomi de către electronii lor, care le permit să construiască structuri mai mari și mai complexe: molecule.
Aceste legături pot fi de diferite soiuri, dar cele mai frecvente în acest domeniu de studiu sunt covalenții. Legăturile covalente, numite și legături moleculare, sunt un tip de legătură în care atomii implicați împărtășesc perechi de electroni.
Acest lucru poate apărea din cauza necesității atomilor de a căuta stabilitate, formând astfel majoritatea compușilor cunoscuți. În acest sens, legăturile covalente pot fi simple, duble sau triple, în funcție de configurația orbitalilor lor și de numărul de perechi de electroni împărțiți între atomii implicați..
Acesta este motivul pentru care există două tipuri de legături covalente care se formează între atomi pe baza orientării orbitalilor lor: legături sigma (σ) și legături pi (π)..
Este important să se diferențieze ambele legături, deoarece legătura sigma apare în legături simple și pi în legături multiple între atomi (doi sau mai mulți electroni sunt împărțiți).
Indice articol
- 1 Cum se formează?
- 1.1 Formarea legăturilor pi în diferite specii chimice
- 2 caracteristici
- 3 Exemple
- 4 Referințe
Cum se formează?
Pentru a descrie formarea legăturii pi, mai întâi trebuie discutat procesul de hibridizare, deoarece intervine în unele legături importante..
Hibridizarea este un proces în care se formează orbitali electronici hibrizi; adică unde s și p orbitali atomici de subnivel se pot amesteca. Acest lucru determină formarea orbitalilor sp, spDouă și sp3, care se numesc hibrizi.
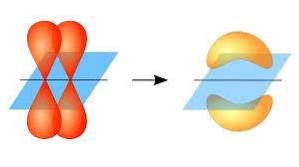
În acest sens, formarea legăturilor pi are loc datorită suprapunerii unei perechi de lobi aparținând unui orbital atomic pe o altă pereche de lobi care se află într-un orbital care face parte dintr-un alt atom..
Această suprapunere orbitală se produce lateral, prin care distribuția electronică este concentrată în mare parte deasupra și sub planul format de nucleii atomici legați și face ca legăturile pi să fie mai slabe decât legăturile sigma..
Atunci când vorbim despre simetria orbitală a acestui tip de uniune, trebuie menționat că este egală cu cea a orbitalilor de tip p atâta timp cât este observată prin axa formată de legătură. Mai mult, aceste uniuni sunt formate în mare parte din orbitali p..
Formarea legăturilor pi în diferite specii chimice
Deoarece legăturile pi sunt întotdeauna însoțite de una sau două legături suplimentare (o sigma sau alta pi și una sigma), este relevant să știm că legătura dublă care se formează între doi atomi de carbon (alcătuită dintr-o sigmă și o legătură pi) are o energie de legătură mai mică decât cea care corespunde de două ori legăturii sigma dintre cele două.
Acest lucru se explică prin stabilitatea legăturii sigma, care este mai mare decât cea a legăturii pi, deoarece suprapunerea orbitalilor atomici din aceasta din urmă are loc în mod paralel în regiunile de deasupra și dedesubtul lobi, acumulând distribuția electronică într-o cale îndepărtată.de nuclei atomici.
În ciuda acestui fapt, atunci când legăturile pi și sigma sunt combinate, se formează o legătură multiplă mai puternică decât legătura simplă în sine, care poate fi verificată prin observarea lungimilor legăturii dintre diferiți atomi de legătură simplă și multiplă..
Există unele specii chimice care sunt studiate pentru comportamentul lor excepțional, cum ar fi compușii de coordonare cu elemente metalice, în care atomii centrali sunt legați doar prin legături pi..
Caracteristici
Caracteristicile care disting legăturile pi de alte tipuri de interacțiuni între speciile atomice sunt descrise mai jos, începând cu faptul că această legătură nu permite mișcarea de rotație liberă a atomilor, cum ar fi carbonul. Din acest motiv, dacă există rotație a atomilor, legătura se rupe..
La fel, în aceste legături suprapunerea dintre orbitali are loc prin două regiuni paralele, realizând că acestea au o difuzie mai mare decât legăturile sigma și că, din acest motiv, sunt mai slabe..
Pe de altă parte, așa cum s-a menționat mai sus, legătura pi este întotdeauna generată între o pereche de orbitali atomici puri; Aceasta înseamnă că este generat între orbitali care nu au suferit procese de hibridizare, în care densitatea electronilor este concentrată mai ales deasupra și sub planul format de legătura covalentă..
În acest sens, între o pereche de atomi poate exista mai mult de o legătură pi, fiind întotdeauna însoțită de o legătură sigma (în legăturile duble).
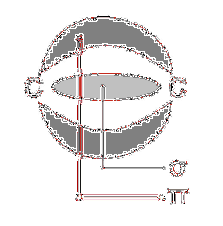
În mod similar, poate exista o legătură triplă între doi atomi adiacenți, care este formată din două legături pi în poziții care formează plane perpendiculare între ele și o legătură sigma între ambii atomi..
Exemple
După cum sa menționat anterior, moleculele formate din atomi uniți prin una sau mai multe legături pi au întotdeauna legături multiple; adică duble sau triple.
Un exemplu în acest sens este molecula de etilenă (HDouăC = CHDouă), care este alcătuită dintr-o dublă legătură; adică o legătură pi și o legătură sigma între atomii lor de carbon, pe lângă legăturile sigma dintre carboni și hidrogeni.
La rândul său, molecula de acetilenă (H-C≡C-H) are o legătură triplă între atomii săi de carbon; adică două legături pi formând planuri perpendiculare și o legătură sigma, pe lângă legăturile lor corespunzătoare sigma carbon-hidrogen.
Legăturile Pi apar și între moleculele ciclice, cum ar fi benzenul (C6H6) și derivații săi, a căror aranjare are ca rezultat un efect numit rezonanță, care permite densității electronilor să migreze între atomi și să ofere, printre altele, o stabilitate mai mare compusului..
Pentru a exemplifica excepțiile menționate anterior, cazurile moleculei de dicarbon (C = C, în care ambii atomi au o pereche de electroni împerecheați) și compusul de coordonare numit hexacarbonil fier (reprezentat ca FeDouă(CO)6, care este format doar de legături pi între atomii săi).
Referințe
- Wikipedia. (s.f.). Pi bond. Recuperat de pe en.wikipedia.org
- Chang, R. (2007). Chimie, ediția a IX-a. Mexic: McGraw-Hill.
- ThoughtCo. (s.f.). Definirea Pi Bond în chimie. Recuperat de la thoughtco.com
- Britannica, E. (s.f.). Pi bond. Adus de la britannica.com
- LibreTexte. (s.f.). Sigma și Pi Bonds. Recuperat de la chem.libretexts.org
- Srivastava, A. K. (2008). Chimia organică simplificată. Recuperat de pe books.google.co.ve



Nimeni nu a comentat acest articol încă.