
Ecuații de echilibru termic, aplicații, exerciții
Echilibrul termic al celor două corpuri aflate în contact termic este starea la care se ajunge după un timp suficient de lung pentru ca temperaturile ambelor corpuri să se egalizeze.
În termodinamică, contactul termic a două corpuri (sau două sisteme termodinamice) este înțeles ca o situație în care corpurile au contact mecanic sau sunt separate, dar în contact cu o suprafață care permite doar trecerea căldurii de la un corp la altul suprafata).
-

Figura 1. După un timp gheața și băutura își vor atinge echilibrul termic. Sursa: pixabay
În contact termic nu trebuie să existe nicio reacție chimică între sistemele în contact. Ar trebui să existe doar schimb de căldură.
Situațiile de zi cu zi în care există schimb de căldură apar cu sisteme precum băutura rece și paharul, cafeaua fierbinte și lingurița, sau corpul și termometrul, printre multe alte exemple..
Indice articol
- 1 Când sunt două sau mai multe sisteme în echilibru termic??
- 2 Ecuații de echilibru termic
- 2.1 Temperatura de echilibru
- 2.2 Contact termic cu schimbare de fază
- 3 Aplicații
- 3.1 -Exercițiunea 1
- 4 exerciții rezolvate
- 4.1 -Exerciția 2
- 4.2 Exercițiul 3
- 4.3-Exercițiu 4
- 5 Referințe
Când două sau mai multe sisteme sunt în echilibru termic?
A doua lege a termodinamicii afirmă că căldura merge întotdeauna de la corpul cu cea mai mare temperatură la corpul cu temperatura cea mai scăzută. Transferul de căldură încetează de îndată ce temperaturile se egalizează și starea de echilibru termic este atinsă..
Aplicația practică a echilibrului termic este termometrul. Un termometru este un dispozitiv care își măsoară propria temperatură, dar datorită echilibrului termic putem cunoaște temperatura altor corpuri, cum ar fi cea a unei persoane sau a unui animal.
Termometrul pe coloană cu mercur este plasat în contact termic cu corpul, de exemplu sub limbă, și se așteaptă suficient timp pentru a se ajunge la echilibrul termic dintre corp și termometru și ca citirea acestuia să nu mai varieze.
Când se atinge acest punct, temperatura termometrului este aceeași cu cea a corpului.
Legea zero a termodinamicii afirmă că dacă un corp A este în echilibru termic cu un corp C și același corp C este în echilibru termic cu B, atunci A și B sunt în echilibru termic chiar și atunci când nu există contact termic între A și B.
Prin urmare, concluzionăm că două sau mai multe sisteme sunt în echilibru termic atunci când au aceeași temperatură.
Ecuații de echilibru termic
Presupunem un corp A cu temperatura inițială Ta în contact termic cu un alt corp B cu temperatura inițială Tb. De asemenea, presupunem că Ta> Tb, apoi conform celei de-a doua legi căldura este transferată de la A la B.
După un timp, echilibrul termic va fi atins și ambele corpuri vor avea aceeași temperatură finală Tf. Aceasta va avea o valoare intermediară la Ta și Tb, adică Ta> Tf> Tb.
Cantitatea de căldură Qa transferată de la A la B va fi Qa = Ma Ca (Tf - Ta), unde Ma este masa corpului A, Ca capacitatea de căldură pe unitate de masă a lui A și (Tf - Ta) diferența de temperatură. Dacă Tf este mai mic decât Ta, atunci Qa este negativ, indicând faptul că corpul A renunță la căldură.
În mod similar pentru corpul B avem acel Qb = Mb Cb (Tf - Tb); iar dacă Tf este mai mare decât Tb atunci Qb este pozitiv, indicând că corpul B primește căldură. Deoarece corpul A și corpul B sunt în contact termic între ele, dar izolate de mediu, cantitatea totală de căldură schimbată trebuie să fie zero: Qa + Qb = 0
Apoi Ma Ca (Tf - Ta) + Mb Cb (Tf - Tb) = 0
Temperatura de echilibru
Dezvoltând această expresie și rezolvând temperatura Tf se obține temperatura finală a echilibrului termic.
-

Figura 2. Temperatura de echilibru final. Sursa: realizat de sine
Tf = (Ma Ca Ta + Mb Cb Tb) / (Ma Ca + Mb Cb).
Ca un caz particular, luați în considerare cazul în care corpurile A și B sunt identice ca masă și capacitate termică, în acest caz temperatura de echilibru va fi:
Tf = (Ta + Tb) / 2 ↔ dacă Ma = Mb și Ca = Cb.
Contact termic cu schimbare de fază
În unele situații se întâmplă ca atunci când două corpuri sunt plasate în contact termic, schimbul de căldură provoacă schimbarea stării sau fazei într-unul dintre ele. Dacă se întâmplă acest lucru, trebuie să se țină seama de faptul că în timpul schimbării de fază nu există nicio schimbare de temperatură în corp care modifică starea sa.
Dacă are loc schimbarea de fază a oricărui corp în contact termic, se aplică conceptul de căldură latentă L, care este energia pe unitate de masă necesară pentru schimbarea stării:
Q = L ∙ M
De exemplu, pentru a topi 1 kg de gheață la 0 ° C sunt necesari 333,5 kJ / kg și această valoare este căldura latentă L a topirii gheții.
În timpul topirii, aceasta se schimbă de la apă solidă la apă lichidă, dar apa menține aceeași temperatură ca și gheața în timpul procesului de topire..
Aplicații
Echilibrul termic face parte din viața de zi cu zi. De exemplu, să examinăm în detaliu această situație:
-Exercitiul 1
O persoană dorește să se scalde în apă caldă la 25 ° C. Într-o găleată, puneți 3 litri de apă rece la 15 ° C și în bucătărie încălziți apă până la 95 ° C.
Câți litri de apă fierbinte ar trebui să adăugați în găleată cu apă rece pentru a avea temperatura finală dorită?
Soluţie
Să presupunem că A este apă rece și B este apă fierbinte:
-
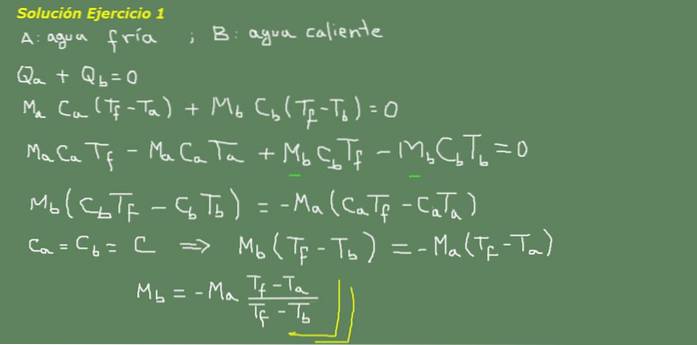
Figura 3. Soluția exercițiului 3. Sursa: elaborare proprie.
Propunem ecuația echilibrului termic, așa cum este indicat pe tablă în figura 3 și de acolo rezolvăm masa apei Mb.
Masa inițială de apă rece poate fi obținută deoarece se cunoaște densitatea apei, care este de 1 kg pe litru. Adică avem 3 kg de apă rece.
Ma = 3 kg
Atunci
Mb = - 3 kg * (25 ° C - 15 ° C) / (25 ° C - 95 ° C) = 0,43 kg
Apoi, 0,43 litri de apă fierbinte sunt suficienți pentru a obține în cele din urmă 3,43 litri de apă caldă la 25 ° C.
Exerciții rezolvate
-Exercițiul 2
O bucată de metal cu o masă de 150 g și o temperatură de 95 ° C este introdusă într-un recipient care conține o jumătate de litru de apă la o temperatură de 18 ° C. După un timp, echilibrul termic este atins, iar temperatura apei și a metalului este de 25 ° C.
Să presupunem că recipientul cu apă și bucata de metal este un termos închis care nu permite schimbul de căldură cu mediul înconjurător.
Obțineți căldura specifică a metalului.
Soluţie
Mai întâi vom calcula căldura absorbită de apă:
Qa = Ma Ca (Tf - Ta)
Qa = 500g 1cal / (g ° C) (25 ° C - 18 ° C) = 3500 calorii.
Aceasta este aceeași căldură dată de metal:
Qm = 150g Cm (25 ° C - 95 ° C) = -3500 calorii.
Deci putem obține capacitatea de căldură a metalului:
Cm = 3500 cal / (150g 70 ° C) = ⅓ cal / (g ° C).
Exercițiul 3
Ai 250 c.c. de apă la 30 ° C. La acea apă care se află într-un termos izolator, se adaugă 25 g de cuburi de gheață la 0 ° C, cu scopul de a o răci..
Determinați temperatura de echilibru; adică temperatura care va rămâne odată ce toată gheața s-a topit și apa cu gheață s-a încălzit pentru a se potrivi inițial cu cea din apa din pahar.
Soluția 3
Acest exercițiu poate fi rezolvat în trei etape:
- Primul este topirea gheții care absoarbe căldura din apa inițială pentru a se topi și a deveni apă..
- Apoi se calculează scăderea temperaturii în apa inițială, datorită faptului că a renunțat la căldură (Qced<0) para fundir el hielo.
- În cele din urmă, apa topită (provenită din gheață) trebuie să fie echilibrată termic cu apa care a existat inițial..
-

Figura 4. Soluția exercițiului 3. Sursa: elaborare proprie.
Să calculăm căldura necesară pentru topirea gheții:
Qf = L * Mh = 333,5 kJ / kg * 0,025 kg = 8,338 kJ
Apoi, căldura dată de apă pentru a topi gheața este Qced = -Qf
Această căldură degajată de apă își reduce temperatura la o valoare T 'pe care o putem calcula după cum urmează:
T '= T0 - Qf / (Ma * Ca) = 22,02 ° C
Unde Ca este capacitatea termică a apei: 4,18 kJ / (kg ° C).
În cele din urmă, masa inițială de apă care este acum la 22,02 ° C va renunța la căldură față de masa apei topite din gheață care se află la 0 ° C..
În cele din urmă, temperatura de echilibru Te va fi atinsă după suficient timp:
Te = (Ma * T '+ Mh * 0 ° C) / (Ma + Mh) = (0,25 kg * 22,02 ° C + 0,025 kg * 0 ° C) / (0,25 kg + 0,025 kg).
În cele din urmă, se obține temperatura de echilibru:
Te = 20,02 ° C.
-Exercițiul 4
O bucată de 0,5 kg de plumb iese din cuptor la o temperatură de 150 ° C, care este cu mult sub punctul său de topire. Această piesă este plasată într-un recipient cu 3 litri de apă la temperatura camerei de 20 ° C. Determinați temperatura de echilibru final.
De asemenea, calculați:
- Cantitatea de căldură furnizată de plumb în apă.
- Cantitatea de căldură absorbită de apă.
Date:
Căldura specifică a plumbului: Cp = 0,03 cal / (g ° C); căldura specifică a apei: Ca = 1 cal / (g ° C).
Soluţie
Mai întâi determinăm temperatura de echilibru final Te:
Te = (Ma Ca Ta + Mp Cp Tp) / (Ma Ca + Mp Cp)
Te = 20,65 ° C
Atunci cantitatea de căldură degajată de plumb este:
Qp = Mp Cp (Te - Tp) = -1,94 x 10³ cal.
Cantitatea de căldură absorbită de apă va fi:
Qa = Ma Ca (Te - Ta) = + 1,94x 10³ cal.
Referințe
- Atkins, P. 1999. Chimie fizică. Ediții Omega.
- Bauer, W. 2011. Fizică pentru inginerie și științe. Volumul 1. Mc Graw Hill.
- Giancoli, D. 2006. Fizică: principii cu aplicații. Al 6-lea ... Ed Prentice Hall.
- Hewitt, Paul. 2012. Științe fizice conceptuale. Al 5-lea. Ed. Pearson.
- Resnick, R. (1999). Fizic. Vol. 1. Ediția a 3-a. În spaniolă. Compañía Editorial Continental S.A. de C.V.
- Rex, A. 2011. Fundamentele fizicii. Pearson.
- Sears, Zemansky. 2016. Fizică universitară cu fizică modernă. 14. Ed. Volumul 1.
- Serway, R., Jewett, J. (2008). Fizică pentru știință și inginerie. Volumul 1. 7. Ed. Cengage Learning.


Nimeni nu a comentat acest articol încă.