
Proprietăți la scară microscopică, numărarea particulelor, exemple
scara microscopica Este una care este utilizată pentru a măsura dimensiunile și lungimile care nu pot fi văzute cu ochiul liber și care au o lungime sub un milimetru. De la cel mai mare la cel mai mic, scalele microscopice din sistemul metric sunt:
- Milimetrul (1 mm), care este o zecime de centimetru sau o miime de metru. În aceasta este scara avem una dintre cele mai mari celule din corp, care este ovulul, a cărui dimensiune este de 1,5 mm.
- Zecea de milimetru (0,1 mm). Aceasta este scara grosimii sau diametrului unui fir de păr uman.
- Micrometrul sau micronul (1μm = 0,001mm). Pe această scară sunt celulele și bacteriile vegetale și animale.
Celulele vegetale sunt de ordinul a 100μm. Celulele animale sunt de zece ori mai mici, este de ordinul a 10μm; în timp ce bacteriile sunt de 10 ori mai mici decât celulele animale și sunt de ordinul a 1μm.
Indice articol
- 1 nanoscală
- 2 Instrumente pentru observarea microscopică
- 3 Proprietăți microscopice
- 3.1-Materia este un gol imens
- 4 Cum se numără particulele la scară microscopică?
- 4.1 -Exemplul 1
- 4.2 -Exemplul 2
- 5 Referințe
Scara nano
Există măsurători chiar mai mici decât scara microscopică, dar nu sunt utilizate în mod obișnuit decât în anumite contexte speciale. Iată câteva dintre cele mai importante măsurători nanometrice:
- Nanometrul (1 ηm = 0,001 μm = 0,000001 mm) este o milionime de milimetru. Pe această scară sunt niște viruși și molecule. Virușii sunt de ordinul 10ηm și moleculele de ordinul 1ηm.
- Angstromul (1Å = 0,1ηm = 0,0001μm = 10-7mm). Această măsurare formează scara sau dimensiunea atomică.
- Fantomometrul (1fm = 0.00001Å = 0.000001ηm = 10-12mm). Aceasta este scara nucleelor atomice, care sunt între 10.000 și 100.000 de ori mai mici decât atomul. Cu toate acestea, în ciuda dimensiunilor sale reduse, nucleul concentrează 99,99% din masa atomică.
- Există nuclee atomice mai mici, deoarece acestea sunt formate din particule precum protoni și neutroni. Dar există mai multe: aceste particule sunt la rândul lor alcătuite din particule mai fundamentale, cum ar fi quark-urile..
Instrumente pentru observarea microscopică
Când obiectele se află între cântare de milimetru și micrometru (1 mm - 0,001 mm), acestea pot fi observate cu un microscop optic.
Cu toate acestea, dacă obiectele sau structurile sunt între nanometri și angstromi, atunci vor fi necesare microscopuri electronice sau nanoscop..
În microscopia electronică, în loc de lumină, se folosesc electroni cu energie mare, care au o lungime de undă mult mai mică decât lumina. Dezavantajul microscopului electronic este că nu este posibil să plasați probe vii în el, deoarece funcționează sub vid..
În schimb, nanoscopul utilizează lumina laser și are avantajul față de microscopia electronică că structurile și moleculele dintr-o celulă vie pot fi privite și înregistrate..
Nanotehnologia este tehnologia cu care circuitele, structurile, piesele și chiar motoarele sunt fabricate pe scări care merg de la nanometru la scara atomică.
Proprietăți microscopice
În fizică, într-o primă aproximare, comportamentul materiei și al sistemelor este studiat din punct de vedere macroscopic. Din această paradigmă, materia este un continuum infinit divizibil; iar acest punct de vedere este valid și potrivit pentru multe situații din viața de zi cu zi.
Cu toate acestea, unele fenomene din lumea macroscopică pot fi explicate numai dacă sunt luate în considerare proprietățile microscopice ale materiei..
Din punct de vedere microscopic, se ia în considerare structura moleculară și atomică a materiei. Spre deosebire de abordarea macroscopică, pe această scară există o structură granulară cu goluri și spații între molecule, atomi și chiar în interiorul acestora..
Cealaltă caracteristică din punct de vedere microscopic în fizică este aceea că o bucată de materie, oricât de mică, este compusă dintr-un număr enorm de particule separate una de alta și în mișcare continuă..
-Materia este un gol imens
Într-o mică bucată de materie, distanța dintre atomi este enormă în comparație cu dimensiunea lor, dar la rândul ei atomii sunt enorme în comparație cu propriile nuclee, unde 99,99% din masă este concentrată..
Adică, o bucată de materie la scara microscopică este un vid imens cu concentrații de atomi și nuclei care ocupă o mică parte din volumul total. În acest sens, scara microscopică este similară cu scara astronomică..
De la obiecte macroscopice până la descoperirea atomului
Primii chimiști, care erau alchimiști, și-au dat seama că materialele ar putea fi de două tipuri: pure sau compuse. Astfel s-a ajuns la ideea elementelor chimice.
Primele elemente chimice descoperite au fost cele șapte metale ale antichității: argint, aur, fier, plumb, staniu, cupru și mercur. În timp, s-au descoperit mai multe în măsura în care s-au găsit substanțe care nu puteau fi descompuse în altele.
Apoi elementele au fost clasificate în funcție de proprietățile și caracteristicile lor în metale și nemetale. Toți cei care aveau proprietăți similare și afinitate chimică au fost grupați în aceeași coloană și astfel a apărut tabelul periodic al elementelor..
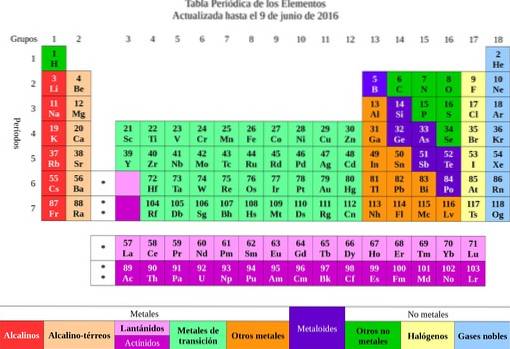
Din elemente s-a trecut ideea atomilor, cuvânt care înseamnă indivizibil. La scurt timp, oamenii de știință au realizat că atomii au o structură. În plus, atomii aveau două tipuri de încărcare electrică (pozitivă și negativă).
Particule subatomice
În experimentele lui Rutherford în care a bombardat atomii unei plăci subțiri de aur cu particule alfa, s-a dezvăluit structura atomului: un mic nucleu pozitiv înconjurat de electroni.
Atomii au continuat să fie bombardați cu din ce în ce mai multe particule de energie și încă se fac, pentru a dezlega secretele și proprietățile lumii microscopice la o scară tot mai mică..
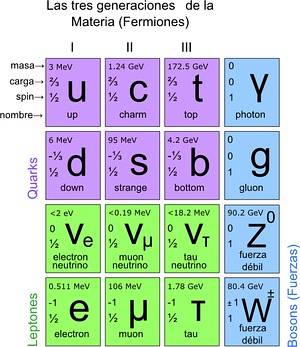
În acest fel, s-a ajuns la modelul standard, în care se stabilește că adevăratele particule elementare sunt cele din care sunt compuși atomii. La rândul lor, atomii dau naștere la elemente, acestea la compuși și la toate interacțiunile cunoscute (cu excepția gravitației). În total sunt 12 particule.
Aceste particule fundamentale au și tabelul lor periodic. Există două grupuri: particulele fermionice ½-spin și cele bosonice. Bosonii sunt responsabili pentru interacțiuni. Fermionicele sunt 12 și sunt cele care dau naștere la protoni, neutroni și atomi.
Cum se numără particulele la scară microscopică?
De-a lungul timpului, chimiștii au descoperit masele relative ale elementelor din măsurători precise în reacțiile chimice. Astfel, de exemplu, s-ar putea determina că carbonul este de 12 ori mai greu decât hidrogenul..
Hidrogenul a fost, de asemenea, determinat a fi cel mai ușor element, astfel încât acestui element i s-a atribuit masa relativă 1.
Pe de altă parte, chimiștii au cerut să cunoască numărul de particule implicate într-o reacție, astfel încât să nu depășească sau să lipsească niciun reactiv. De exemplu, o moleculă de apă necesită doi atomi de hidrogen și unul de oxigen..
Din aceste antecedente se naște conceptul de aluniță. Un mol al oricărei substanțe este un număr fix de particule echivalent cu masa sa moleculară sau atomică în grame. Astfel s-a stabilit că 12 grame de carbon au același număr de particule ca 1 gram de hidrogen. Acest număr este cunoscut sub numele de Avogadro: 6,02 x 10 ^ 23 particule.
-Exemplul 1
Calculați câți atomi de aur sunt în 1 gram de aur.
Soluţie
Se știe că aurul are o greutate atomică de 197. Aceste date pot fi găsite în tabelul periodic și indică faptul că un atom de aur este de 197 ori mai greu decât unul dintre hidrogen și 197/12 = 16.416 ori mai greu decât carbonul..
Un mol de aur are 6,02 × 10 ^ 23 atomi și are greutatea atomică exprimată în grame, adică 197 grame.
Într-un gram de aur există 1/197 moli de aur, adică 6,02 × 10 ^ 23 atomi / 197 = 3,06 x10 ^ 23 atomi de aur.
-Exemplul 2
Determinați numărul de molecule de carbonat de calciu (CaCO3) care sunt în 150 de grame din această substanță. De asemenea, spuneți câți atomi de calciu, câți carbon și cât oxigen sunt în acest compus.
Soluţie
Primul lucru este determinarea masei moleculare a carbonatului de calciu. Tabelul periodic indică faptul că calciul are o greutate moleculară de 40 g / mol, carbon 12 g / mol și oxigen 16 g / mol..
Apoi, masa moleculară a (CaCO3) va fi :
40 g / mol + 12 g / mol + 3 x 16 g / mol = 100 g / mol
La fiecare 100 de grame de carbonat de calciu este 1mol. Deci, în 150 de grame, acestea corespund la 1,5 moli.
Fiecare mol de carbonat are 6,02 x 10 ^ 23 molecule de carbonat, deci în 1,5 moli de carbonat există 9,03 x 10 ^ 23 molecule.
Pe scurt, în 150 de grame de carbonat de calciu există:
- 9,03 x 10 ^ 23 molecule de carbonat de calciu.
- Atomi de calciu: 9,03 x 10 ^ 23 .
- De asemenea, 9,03 x 10 ^ 23 atomi de carbon
- În cele din urmă, 3 x 9,03 x 10 ^ 23 atomi de oxigen = 27,09 x 10 ^ 23 atomi de oxigen.
Referințe
- Biologie aplicată. Care sunt măsurătorile microscopice? Recuperat de pe: youtube.com
- Educație chimică. Reprezentări macroscopice, submicroscopice și simbolice asupra materiei. Recuperat de pe: scielo.org.mx.
- García A. Curs de fizică interactivă. Macro-stări, microstate. Temperatura, Entropia. Recuperat de pe: sc.ehu.es
- Structura microscopică a materiei. Recuperat de pe: alipso.com
- Wikipedia. Nivel microscopic. Recuperat de pe: wikipedia.com



Nimeni nu a comentat acest articol încă.