
Structura structurii cristaline, tipuri și exemple
structură cristalină Este una dintre stările solide pe care atomii, ionii sau moleculele le pot adopta în natură, care se caracterizează printr-o ordonare spațială ridicată. Cu alte cuvinte, aceasta este o dovadă a „arhitecturii corpusculare” care definește multe corpuri cu apariții sticloase și strălucitoare..
Ce promovează sau ce forță este responsabilă pentru această simetrie? Particulele nu sunt singure, dar interacționează între ele. Aceste interacțiuni consumă energie și afectează stabilitatea solidelor, astfel încât particulele caută să se acomodeze pentru a minimiza această pierdere de energie..

Deci natura lor intrinsecă îi determină să se plaseze în aranjamentul spațial cel mai stabil. De exemplu, acesta poate fi cel în care repulsiile dintre ioni cu aceleași sarcini sunt minime sau unde unii atomi - precum metalici - ocupă, de asemenea, cel mai mare volum posibil în ambalajele lor..
Cuvântul „cristal” are o semnificație chimică care poate fi denaturată pentru alte corpuri. Din punct de vedere chimic, se referă la o structură ordonată (microscopic) care, de exemplu, poate consta din molecule de ADN (un cristal de ADN).
Cu toate acestea, în mod popular este folosit în mod greșit pentru a se referi la orice obiect sau suprafață sticloasă, cum ar fi oglinzi sau sticle. Spre deosebire de cristalele adevărate, sticla constă dintr-o structură amorfă (dezordonată) de silicați și mulți alți aditivi..
Indice articol
- 1 Structură
- 1.1 Celula unitară
- 2 tipuri
- 2.1 Conform sistemului său cristalin
- 2.2 Conform naturii sale chimice
- 3 Exemple
- 3.1 K2Cr2O7 (sistem triclinic)
- 3.2 NaCl (sistem cubic)
- 3.3 ZnS (wurtzite, sistem hexagonal)
- 3.4 CuO (sistem monoclinic)
- 4 Referințe
Structura
În imaginea de mai sus sunt ilustrate câteva pietre de smarald. La fel ca acestea, multe alte minerale, săruri, metale, aliaje și diamante prezintă o structură cristalină; dar, ce relație are ordonarea sa cu simetria?
Dacă unui cristal, ale cărui particule ar putea fi observate cu ochiul liber, li se aplică operații de simetrie (inversați-l, rotiți-l la unghiuri diferite, reflectați-l într-un plan etc.), atunci se va constata că rămâne intact în toate dimensiunile de spațiu..
Opusul se întâmplă pentru un solid amorf, din care se obțin diferite ordine supunându-l unei operații de simetrie. În plus, îi lipsesc modele structurale de repetare, ceea ce arată aleatoritatea în distribuția particulelor sale..
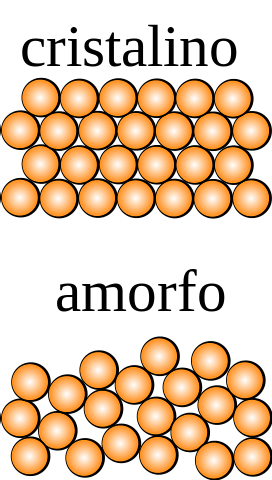
Care este cea mai mică unitate care alcătuiește modelul structural? În imaginea superioară, solidul cristalin este simetric în spațiu, în timp ce cel amorf nu este..
Dacă s-ar fi trasat pătrate care s-au închis sferelor portocalii și li s-ar aplica operații de simetrie, s-ar constata că generează alte părți ale cristalului.
Cele de mai sus se repetă cu pătrate din ce în ce mai mici, până la găsirea celui asimetric; cea care o precedă ca mărime este, prin definiție, celula unitară.
Celula unitară
Celula unitară este expresia structurală minimă care permite reproducerea completă a solidului cristalin. Din aceasta este posibil să asamblați sticla, mișcându-l în toate direcțiile spațiului.
Poate fi considerat ca un sertar mic (portbagaj, găleată, recipient etc.) unde particulele, reprezentate de sfere, sunt așezate urmând un model de umplere. Dimensiunile și geometriile acestei casete depind de lungimile axelor sale (a, b și c), precum și de unghiurile dintre ele (α, β și γ).
Cea mai simplă dintre toate celulele unitare este cea a structurii cubice simple (imaginea superioară (1)). În aceasta, centrul sferelor ocupă colțurile cubului, patru la baza sa și patru la tavan..
În acest aranjament, sferele ocupă doar 52% din volumul total al cubului și, din moment ce natura urăște vidul, nu mulți compuși sau elemente adoptă această structură..
Cu toate acestea, dacă sferele sunt dispuse în același cub în așa fel încât să ocupe centrul (cubic centrat în corp, bcc), atunci va exista un ambalaj mai compact și mai eficient (2). Acum sferele ocupă 68% din volumul total.
Pe de altă parte, în (3) nici o sferă nu ocupă centrul cubului, ci centrul fețelor sale, și toate ocupă până la 74% din volumul total (cub centrat pe față, cc).
Astfel, se poate observa că pentru același cub se pot obține alte aranjamente, variind modul în care sunt împachetate sferele (ioni, molecule, atomi etc.).
Tipuri
Structurile cristaline pot fi clasificate în funcție de sistemele lor cristaline sau de natura chimică a particulelor lor..
De exemplu, sistemul cubic este cel mai comun dintre toate și multe solide cristaline sunt guvernate de acesta; Cu toate acestea, același sistem se aplică atât cristalelor ionice, cât și cristalelor metalice..
Conform sistemului său cristalin
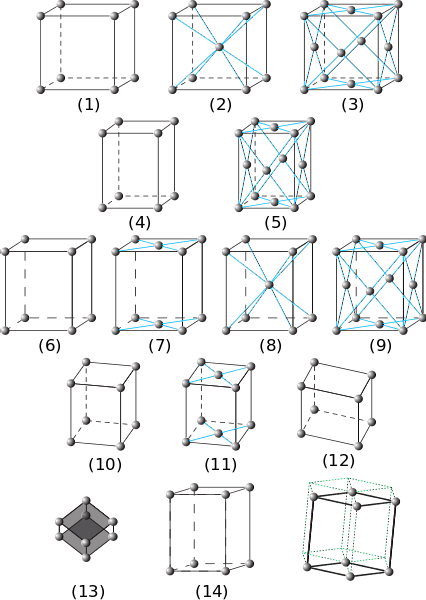
În imaginea anterioară sunt reprezentate cele șapte sisteme principale de cristale. Se poate observa că există de fapt paisprezece dintre acestea, care sunt produsul altor forme de ambalare pentru aceleași sisteme și alcătuiesc rețelele Bravais.
De la (1) la (3) sunt cristale cu sisteme de cristale cubice. În (2) se observă (prin dungile albastre) că sfera din centru și cea a colțurilor interacționează cu opt vecini, astfel încât sferele au un număr de coordonare de 8. Și în (3) numărul de coordonare este 12 ( pentru a-l vedea, trebuie să copiați cubul în orice direcție).
Elementele (4) și (5) corespund sistemelor tetragonale simple și centrate pe față. Spre deosebire de cub, axa sa c este mai lungă decât axele a și b.
De la (6) la (9) sunt sistemele ortorombice: de la cele simple și centrate pe baze (7), până la cele centrate pe corp și pe fețe. În acestea α, β și γ sunt 90º, dar toate laturile sunt de lungimi diferite.
Figurile (10) și (11) sunt cristalele monoclinice și (12) este cea triclinică, ultima prezentând inegalități în toate unghiurile și axele sale..
Elementul (13) este sistemul romboedru, analog celui cubic, dar cu un unghi γ diferit de 90º. În cele din urmă sunt cristalele hexagonale
Deplasările elementelor (14) originează prisma hexagonală trasată de liniile punctate verzi.
După natura sa chimică
- Dacă cristalele sunt formate din ioni, atunci acestea sunt cristale ionice prezente în săruri (NaCl, CaSO4, CuClDouă, KBr etc.)
- Moleculele precum glucoza formează (ori de câte ori pot) cristale moleculare; în acest caz, celebrele cristale de zahăr.
- Atomii ale căror legături sunt în esență covalente formează cristale covalente. Astfel sunt cazurile de diamant sau carbură de siliciu.
- De asemenea, metalele precum aurul formează structuri cubice compacte, care constituie cristale metalice..
Exemple
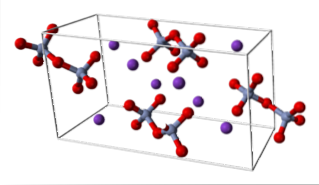
KDouăCrDouăSAU7 (sistem triclinic)
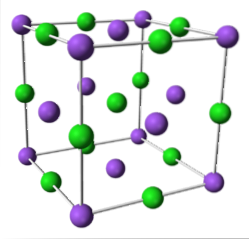
NaCl (sistem cubic)
ZnS (wurtzite, sistem hexagonal)
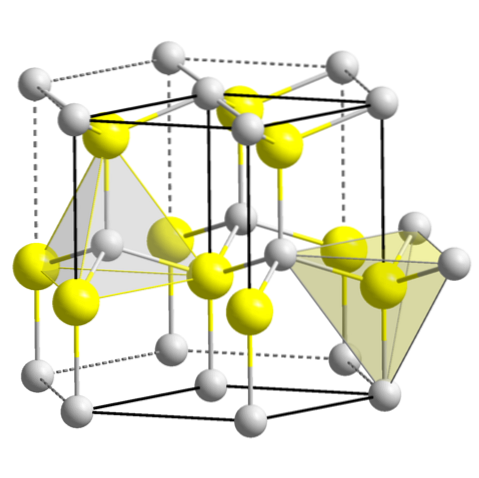
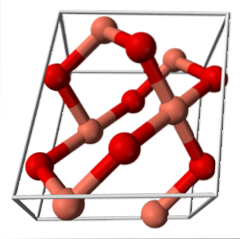
CuO (sistem monoclinic)
Referințe
- Quimitube. (2015). De ce „cristalele” nu sunt cristale. Adus pe 24 mai 2018, de pe: quimitube.com
- Caiete de presă. 10.6 Structuri de rețea în solide cristaline. Adus pe 26 mai 2018, de pe: opentextbc.ca
- Centrul de Resurse Academice Structuri de Cristal. [PDF]. Adus pe 24 mai 2018, de pe: web.iit.edu
- Ming. (30 iunie 2015). Tipuri Structuri de cristal. Adus pe 26 mai 2018, de pe: crystalvisions-film.com
- Helmenstine, Anne Marie, dr. (31 ianuarie 2018). Tipuri de cristale. Adus pe 26 mai 2018, de pe: thoughtco.com
- KHI. (2007). Structuri cristaline. Adus pe 26 mai 2018, de pe: folk.ntnu.no
- Paweł Maliszczak. (25 aprilie 2016). Cristale aspre de smarald din Valea Panjshir din Afganistan. [Figura]. Adus pe 24 mai 2018, de pe: commons.wikimedia.org
- Napy1kenobi. (26 aprilie 2008). Grile Bravais. [Figura]. Adus pe 26 mai 2018, de pe: commons.wikimedia.org
- Utilizator: Sbyrnes321. (21 noiembrie 2011). Cristalin sau amorf. [Figura]. Adus pe 26 mai 2018, de pe: commons.wikimedia.org



Nimeni nu a comentat acest articol încă.