
Istoricul fluorului, proprietățile, structura, obținerea, riscurile, utilizările
fluor Este un element chimic care este reprezentat de simbolul F și grupul de capete 17, căruia îi aparțin halogenii. Se distinge deasupra celorlalte elemente ale tabelului periodic, pentru că este cel mai reactiv și electronegativ; reacționează cu aproape toți atomii, deci formează nenumărate săruri și compuși organofluorinați.
În condiții normale, este un gaz galben pal, care poate fi confundat cu verde gălbui. În stare lichidă, prezentată în imaginea de mai jos, culoarea sa galbenă se intensifică puțin mai mult, care dispare complet atunci când se solidifică la punctul său de îngheț..

Atât este reactivitatea sa, în ciuda naturii volatile a gazului său, încât rămâne prinsă în scoarța terestră; mai ales sub forma fluoritului mineral, cunoscut pentru cristalele sale violete. La fel, reactivitatea sa îl face o substanță potențial periculoasă; reacționează energic la tot ceea ce atinge și arde în flăcări.
Cu toate acestea, multe dintre subprodusele sale pot fi inofensive și chiar benefice, în funcție de aplicațiile lor. De exemplu, cea mai populară utilizare a fluorului, adăugată în forma sa ionică sau minerală (cum ar fi sărurile de fluor), este prepararea pastelor de dinți cu fluor, care ajută la protejarea smalțului dinților..
Fluorul are particularitatea că poate stabiliza numărul ridicat sau stările de oxidare pentru multe alte elemente. Cu cât numărul atomilor de fluor este mai mare, cu atât compusul este mai reactiv (dacă nu este un polimer). La fel, efectele sale cu matrici moleculare vor crește; pentru mai bine sau mai rău.
Indice articol
- 1 Istorie
- 1.1 Utilizarea fluoritului
- 1.2 Prepararea acidului fluorhidric
- 1.3 Izolarea
- 1.4 Interesul pentru fluor
- 2 Proprietăți fizice și chimice
- 2.1 Aspect
- 2.2 Număr atomic (Z)
- 2.3 Greutatea atomică
- 2.4 Punct de topire
- 2.5 Punctul de fierbere
- 2.6 Densitate
- 2.7 Căldura de vaporizare
- 2.8 Capacitatea de căldură molară
- 2.9 Presiunea vaporilor
- 2.10 Conductivitate termică
- 2.11 Ordinea magnetică
- 2.12 Miros
- 2.13 numere de oxidare
- 2.14 Energia de ionizare
- 2.15 Electronegativitate
- 2.16 Agent oxidant
- 2.17 Reactivitate
- 3 Structură și configurație electronică
- 3.1 Molecula diatomică
- 3.2 Lichid și solid
- 4 Unde se găsește și se obține
- 4.1 Prelucrarea fluoritului
- 4.2 Electroliza fluorurii de hidrogen
- 5 izotopi
- 6 Rolul biologic
- 7 Riscuri
- 7.1 Fluoroza dentară
- 7.2 Fluoroza scheletică
- 8 utilizări
- 8.1 Pastele de dinți
- 8.2 Fluorarea apei
- 8.3 Agent oxidant
- 8.4 Polimeri
- 8.5 Farmaciști
- 8.6 Gravarea sticlei
- 8.7 Îmbogățirea uraniului
- 9 Referințe
Poveste
Utilizarea fluoritului
În 1530, mineralogul german Georgius Agricola a descoperit că fluorsparul mineral ar putea fi utilizat în purificarea metalelor. Fluorspar este un alt nume pentru fluorit, un mineral de fluor care consta din fluorură de calciu (CaFDouă).
Elementul fluor nu fusese descoperit până atunci și „fluoir” în fluorit provine din cuvântul latin „fluere” care înseamnă „a curge”; întrucât, tocmai asta a făcut fluorsparul sau fluoritul cu metalele: i-a ajutat să părăsească proba.
Prepararea acidului fluorhidric
În 1764, Andreas Sigismud Margraff a reușit să pregătească acid fluorhidric, încălzind fluoritul cu acid sulfuric. Replicile de sticlă au fost topite prin acțiunea acidului, astfel încât sticla a fost înlocuită cu metale.
Este atribuit și lui Carl Scheele în 1771, prepararea acidului prin aceeași metodă urmată de Margraff. În 1809, omul de știință francez Andre-Marie Ampere a propus că acidul fluor sau fluorhidric era un compus format din hidrogen și un element nou asemănător cu clorul..
Oamenii de știință au încercat să izoleze fluorul folosind acid fluorhidric mult timp; dar pericolul său a făcut progresul în acest sens dificil.
Humphry Davy, Joseph Louis Gay-Lussac și Jacques Thénard au avut dureri severe atunci când au inhalat fluorură de hidrogen (acid fluorhidric fără apă și sub formă gazoasă). Oamenii de știință Paulin Louyet și Jerome Nickles au murit de otrăvire în circumstanțe similare.
Edmond Frémy, cercetător francez, a încercat să creeze acid fluorhidric uscat pentru a evita toxicitatea fluorurii de hidrogen prin acidificarea bifluorurii de potasiu (KHF)Două), dar în timpul electrolizei nu a existat conducerea curentului electric.
Izolare
În 1860, chimistul englez George Gore a încercat electroliza acidului fluorhidric uscat și a reușit să izoleze o cantitate mică de fluor fluor. Cu toate acestea, a avut loc o explozie pe măsură ce hidrogenul și fluorul s-au recombinat violent. Gore a atribuit explozia unei scurgeri de oxigen..
În 1886, chimistul francez Henri Moisson a reușit să izoleze fluorul pentru prima dată. Anterior, activitatea lui Moisson a fost întreruptă de patru ori de otrăvirea severă cu fluorură de hidrogen, în timp ce încerca să izoleze elementul..
Moisson a fost student al lui Frémy și s-a bazat pe experimentele sale pentru a izola fluorul. Moisson a folosit un amestec de fluorură de potasiu și acid fluorhidric în electroliză. Soluția rezultată a condus electricitatea și gazul fluor colectat la anod; adică la electrodul încărcat pozitiv.
Moisson a folosit echipamente rezistente la coroziune, în care electrozii erau confecționați dintr-un aliaj de platină și iridiu. În electroliză, el a folosit un recipient de platină și a răcit soluția de electroliți la o temperatură de -23 ° F (-31 ° C)..
În cele din urmă, la 26 iunie 1886, Henri Moissson a reușit izolarea fluorului, lucru care i-a permis să câștige Premiul Nobel în 1906.
Interes pentru fluor
Interesul pentru cercetarea fluorului s-a pierdut pentru o vreme. Cu toate acestea, dezvoltarea Proiectului Manhattan pentru producerea bombei atomice a stimulat-o din nou.
Compania americană Dupont a dezvoltat, între anii 1930 și 1940, produse fluorurate precum clorofluorocarburi (Freon-12), utilizate ca agenți frigorifici; și plasticul politetrafluoretilenic, mai cunoscut sub numele de teflon. Acest lucru a produs o creștere a producției și a consumului de fluor..
În 1986, la o conferință la aproximativ un secol de la izolarea fluorului, chimistul american Karl O. Christe a prezentat o metodă chimică pentru prepararea fluorului prin reacția dintre KDouăMnF6 și SbF5.
Proprietati fizice si chimice
Aspect
Fluorul este un gaz galben pal. În stare lichidă este galben strălucitor. Între timp, solidul poate fi opac (alfa) sau transparent (beta).
Număr atomic (Z)
9.
Greutate atomica
18.998 u.
Punct de topire
-219,67 ºC.
Punct de fierbere
-188,11 ºC.
Densitate
La temperatura camerei: 1,696 g / L.
La punctul de topire (lichid): 1,505 g / ml.
Căldura de vaporizare
6,51 kJ / mol.
Capacitatea de căldură molară
31 J / (mol K).
Presiunea de vapori
La o temperatură de 58 K are o presiune de vapori de 986,92 atm.
Conductivitate termică
0,0277 W / (m K)
Ordinea magnetică
Diamagnetic
Miros
Miros caracteristic și înțepător, detectabil chiar și la 20 ppb.
Numere de oxidare
-1, care corespunde anionului fluor, F-.
Energie de ionizare
-Primul: 1.681 kJ / mol
-În al doilea rând: 3.374 kJ / mol
-În al treilea rând: 6.147 KJ / mol
Electronegativitate
3,98 pe scara Pauling.
Este elementul chimic cu cele mai mari electronegativități; adică are o afinitate mare pentru electronii atomilor cu care se leagă. Din această cauză, atomii de fluor generează momente dipolare mari în regiuni specifice ale unei molecule..
Electronegativitatea sa are, de asemenea, un alt efect: atomii legați de aceasta pierd atât de multă densitate de electroni încât încep să dobândească o sarcină pozitivă; acesta este un număr de oxidare pozitiv. Cu cât sunt mai mulți atomi de fluor într-un compus, atomul central va avea un număr de oxidare mai pozitiv..
De exemplu, în OFDouă oxigenul are un număr de oxidare de +2 (ODouă+FDouă-); în UF6, Uraniul are un număr de oxidare de +6 (U6+F6-); la fel se întâmplă cu sulful din SF6 (S6+F6-); și în sfârșit există AgFDouă, unde argintul are chiar și un număr de oxidare de +2, rar pentru el.
Prin urmare, elementele reușesc să participe cu cel mai pozitiv număr de oxidare atunci când formează compuși cu fluor..
Agent oxidant
Fluorul este cel mai puternic element oxidant, deci nicio substanță nu este capabilă să-l oxideze; și din acest motiv, nu se găsește liber în natură.
Reactivitate
Fluorul este capabil să se combine cu toate celelalte elemente, cu excepția heliului, neonului și argonului. De asemenea, nu atacă oțelul sau cuprul ușor la temperaturi normale. Reacționează violent cu materiale organice precum cauciuc, lemn și țesături.
Fluorul poate reacționa cu gazul noble xenon pentru a forma difluorura de xenon oxidant puternic, XeFDouă. De asemenea, reacționează cu hidrogenul pentru a forma o halogenură, fluorură de hidrogen, HF. La rândul său, fluorura de hidrogen se dizolvă în apă pentru a produce faimosul acid fluorhidric (ca sticla).
Aciditatea acizilor acizi, clasificați în ordine crescătoare este:
HF < HCl < HBr < HI
Acidul azotic reacționează cu fluorul pentru a forma azotat de fluor, FNO3. Între timp, acidul clorhidric reacționează energic cu fluorul pentru a forma HF, OFDouă și ClF3.
Structura și configurația electronică

Molecula diatomică

Atomul de fluor aflat în starea sa de bază are șapte electroni de valență, care se află pe orbitalele 2s și 2p conform configurației electronice:
[El] 2sDouă 2 P5
Teoria legăturii de valență (TEV) afirmă că doi atomi de fluor, F, sunt legați covalent la fiecare octet de valență.
Acest lucru se întâmplă rapid, deoarece este nevoie de un singur electron pentru a deveni izoelectronic pentru gazul nobil neon; iar atomii săi sunt foarte mici, cu o sarcină nucleară eficientă foarte puternică care solicită cu ușurință electroni din mediu.
Molecula FDouă (imaginea de sus), are o legătură covalentă simplă, F-F. În ciuda stabilității sale în comparație cu atomii F liberi, este o moleculă foarte reactivă; homonucleare, apolare și dornice de electroni. De aceea, fluorul, ca FDouă, este o specie foarte toxică și periculoasă.
Pentru că FDouă este apolar, interacțiunile sale depind de masa sa moleculară și de forțele de împrăștiere ale Londrei. La un moment dat, norul electronic din jurul ambilor atomi F trebuie să se deformeze și să genereze un dipol instantaneu care îl induce pe altul într-o moleculă vecină; astfel încât să se atragă reciproc încet și slab.
Lichid și solid
Molecula FDouă este foarte mic și se difuzează în spațiu relativ repede. În faza sa gazoasă, prezintă o culoare galben pal (care poate fi confundată cu un verde lime). Când temperatura scade la -188 ºC, forțele de dispersie devin mai eficiente și fac moleculele F.Două se unesc suficient pentru a defini un lichid.
Fluorul lichid (prima imagine) pare chiar mai galben decât gazul respectiv. În ea, moleculele FDouă sunt mai apropiați și interacționează cu lumina într-un grad mai mare. Interesant este că, odată ce cristalul de fluor cubic distorsionat se formează la -220 ° C, culoarea se estompează și rămâne ca un solid transparent..
Acum că moleculele F.Două sunt atât de apropiați (dar fără oprirea rotațiilor lor moleculare), se pare că electronii lor câștigă o anumită stabilitate și, prin urmare, saltul lor electronic este prea mare pentru ca lumina să interacționeze chiar cu cristalul.
Fazele cristaline
Acest cristal cub corespunde fazei β (nu este un alotrop deoarece este încă același FDouă). Când temperatura scade și mai mult, până la -228 ° C, fluorul solid suferă o tranziție de fază; cristalul cub devine unul monoclinic, faza α:
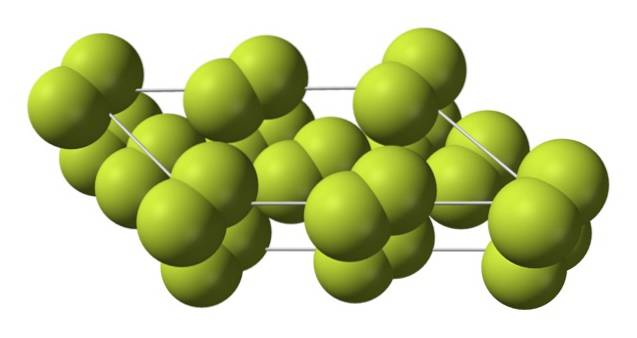
Spre deosebire de β-FDouă, α-FDouă este opac și dur. Poate că se datorează moleculelor F.Două nu mai au atâta libertate de a se roti în pozițiile lor fixe pe cristale monoclinice; unde interacționează într-un grad mai mare cu lumina, dar fără a-și excita electronii (ceea ce ar explica superficial opacitatea lor).
Structura cristalină a α-FDouă a fost dificil de studiat prin metode convenționale de difracție cu raze X. Acest lucru se datorează faptului că trecerea de la faza β la faza α este extrem de exotermă; deci cristalul a explodat practic, în același timp în care a avut puțină interacțiune cu radiațiile.
A trecut aproximativ cincizeci de ani până când oamenii de știință germani (Florian Kraus și colab.) Au descifrat complet structura α-FDouă mai precis datorită tehnicilor de difracție a neutronilor.
Unde se găsește și se obține
Fluorul ocupă locul 24 printre cele mai frecvente elemente din Univers. Cu toate acestea, pe Pământ este masa 13vo element, cu o concentrație de 950 ppm în scoarța terestră și o concentrație de 1,3 ppm în apa de mare.
Solurile au o concentrație de fluor între 150 și 400 ppm, iar în unele soluri concentrația poate ajunge la 1.000 ppm. În aerul atmosferic este prezent într-o concentrație de 0,6 ppb; dar a fost înregistrat în unele orașe până la 50 ppb.
Fluorul este obținut în principal din trei minerale: fluorit sau fluorospar (CaFDouă), fluoroapatit [Ca5(PO4)3F] și criolit (Na3AlF6).
Prelucrarea fluoritului
După colectarea rocilor cu fluoritul mineral, acestea sunt supuse unei zdrobiri primare și secundare. Cu zdrobirea secundară se obțin fragmente de rocă foarte mici.
Fragmentele de rocă sunt apoi duse la o moară cu bile pentru reducere la pulbere. Apa și reactivii sunt adăugați pentru a forma o pastă, care este plasată într-un rezervor de flotație. Aerul este injectat sub presiune pentru a forma bule și astfel fluorita ajunge să plutească pe suprafața apoasă.
Silicații și carbonații se instalează în timp ce fluorita este colectată și dusă la cuptoarele de uscare..
Odată ce fluoritul este obținut, acesta reacționează cu acid sulfuric pentru a produce fluorură de hidrogen:
CaFDouă + HDouăSW4 => 2 HF + CaSO4
Electroliza fluorurii de hidrogen
În producția de fluor, este urmată metoda utilizată de Moisson în 1886, cu unele modificări..
O electroliză este realizată dintr-un amestec de fluorură de potasiu topită și acid fluorhidric, cu un raport molar de 1: 2,0 la 1: 2,2. Temperatura sării topite este de 70 - 130 ºC.
Catodul este format dintr-un aliaj Monel sau oțel, iar anodul este carbon degrafit. Procesul de producere a fluorului în timpul electrolizei poate fi conturat după cum urmează:
2HF => HDouă + FDouă
Apa este utilizată pentru răcirea camerei de electroliză, dar temperatura trebuie să fie peste punctul de topire a electrolitului pentru a evita solidificarea. Hidrogenul produs în electroliză este colectat la catod, în timp ce fluorul la anod.
Izotopi
Fluorul are 18 izotopi, fiind 19F singurul izotop stabil cu 100% abundență. 18F are un timp de înjumătățire de 109,77 minute și este izotopul radioactiv al fluorului cu cel mai lung timp de înjumătățire. 18F este folosit ca sursă de pozitroni.
Rolul biologic
Nu se cunoaște activitate metabolică a fluorului la mamifere sau plante superioare. Cu toate acestea, unele plante și bureți marini sintetizează monofluoroacetat, un compus otrăvitor, pe care îl folosesc ca protecție pentru a preveni distrugerea acestuia.
Riscuri
Consumul excesiv de fluor a fost asociat cu fluoroză osoasă la adulți și fluoroză dentară la copii, precum și modificări ale funcției renale. Din acest motiv, Serviciul de Sănătate Publică al Statelor Unite (PHS) a sugerat că concentrația de fluor în apa potabilă nu trebuie să fie mai mare de 0,7 mg / L.
Între timp, Agenția pentru Protecția Mediului din SUA (EPA) a stabilit că concentrația de fluor în apa de băut nu trebuie să fie mai mare de 4 mg / L, pentru a evita fluorozele scheletice, în care fluorurile se acumulează în oase. Acest lucru poate duce la slăbirea osului și fracturi..
Fluorul a fost asociat cu afectarea glandei paratiroide, cu o scădere a calciului în structurile osoase și concentrații mari de calciu în plasmă..
Printre modificările atribuite excesului de fluor se numără următoarele: fluoroză dentară, fluoroză scheletică și afectarea glandei paratiroide.
Fluoroza dentară
Fluoroza dentară apare cu mici dungi sau pete în smalțul dinților. Copiii cu vârsta sub 6 ani nu trebuie să utilizeze apă de gură care conține fluor..
Fluoroza scheletică
În fluoroză scheletală, durerea și deteriorarea oaselor, precum și a articulațiilor, pot fi diagnosticate. Osul se poate întări și pierde elasticitatea, crescând riscul de fracturi.
Aplicații
Pastă de dinţi

Începem cu secțiunea privind utilizările fluorului cu cea mai cunoscută: aceea de a servi ca o componentă a multor paste de dinți. Aceasta nu este singura utilizare în care este apreciat contrastul dintre molecula sa FDouă, extrem de otrăvitor și periculos, iar anionul F-, care, în funcție de mediu, poate fi benefic (deși uneori nu).
Când mâncăm alimente, în special dulciuri, bacteriile o descompun prin creșterea acidității salivei noastre. Apoi, vine un moment în care pH-ul este suficient de acid pentru a degrada și demineraliza smalțul dinților; hidroxiapatita se descompune.
Cu toate acestea, în acest proces, ionii F- interacționează cu CaDouă+ pentru a forma o matrice fluorapatită; mai stabil și mai durabil decât hidroxiapatita. Sau cel puțin, acesta este mecanismul propus pentru a explica acțiunea anionului fluor pe dinți. Este probabil să fie mai complex și să aibă un echilibru hidroxiapatit-fluorapatit dependent de pH.
Acești anioni F- Sunt disponibile în plante dentare sub formă de săruri; precum: NaF, SnFDouă (celebrul fluor stanos) și NaPOF. Cu toate acestea, concentrația de F- Trebuie să fie scăzut (mai puțin de 0,2%), deoarece în caz contrar provoacă efecte negative asupra organismului.
Fluorarea apei
La fel ca pasta de dinți, sărurile de fluor au fost adăugate la sursele de apă potabilă pentru a combate cavitățile celor care o beau. Concentrația ar trebui să fie în continuare mult mai mică (0,7 ppm). Cu toate acestea, această practică este adesea subiectul neîncrederii și al controverselor, deoarece i s-au atribuit posibile efecte cancerigene.
Agent oxidant
Gaz FDouă se comportă ca un agent oxidant foarte puternic. Acest lucru face ca mulți compuși să ardă mai repede decât atunci când sunt expuși la oxigen și la o sursă de căldură. De aceea a fost folosit în amestecuri de combustibili pentru rachete, în care poate chiar înlocui ozonul.
Polimeri
În multe utilizări, contribuția fluorului nu se datorează FDouă sau F-, dar direct la atomii săi electronegativi ca parte a unui compus organic. În esență, vorbim despre o legătură C-F..
În funcție de structură, polimerii sau fibrele cu legături C-F sunt de obicei hidrofobe, deci nu se udă sau rezistă la atacul acidului fluorhidric; Sau mai bine, pot fi izolatori electrici excelenți și materiale utile din care sunt fabricate obiecte precum țevi și garnituri. Teflonul și nafiunea sunt exemple ale acestor polimeri fluorurați.
Farmaciștii
Reactivitatea fluorului face discutabilă utilizarea sa pentru sinteza mai multor compuși ai fluorului, organici sau anorganici. La organice, în special la cele cu efecte farmacologice, înlocuirea unuia dintre heteroatomii lor cu atomi F crește (pozitiv sau negativ) acțiunea lor asupra țintei biologice..
De aceea, în industria farmaceutică, modificarea unor medicamente prin adăugarea de atomi de fluor este întotdeauna pe masă..
Foarte similar se întâmplă cu erbicidele și fungicidele. Fluorul din ele le poate crește acțiunea și eficacitatea asupra dăunătorilor de insecte și ciuperci..
Gravură pe sticlă
Acidul fluorhidric, datorită agresivității sale cu sticla și ceramica, a fost folosit pentru gravarea unor bucăți subțiri și delicate din aceste materiale; destinate de obicei fabricării de microcomponente de calculatoare sau pentru becuri electrice.
Îmbogățirea uraniului
Una dintre cele mai relevante utilizări ale fluorului elementar este de a ajuta la îmbogățirea uraniului ca. 235U. Pentru aceasta, mineralele de uraniu sunt dizolvate în acid fluorhidric, producând UF4. Această fluorură anorganică reacționează apoi cu FDouă, pentru a se transforma astfel în UF6 (235PHEW6 Da 238PHEW6).
Ulterior și prin centrifugare cu gaz, 235PHEW6 se desparte de 238PHEW6 pentru a fi ulterior oxidat și depozitat ca combustibil nuclear.
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Krämer Katrina. (2019). Structura fluorului congelat revizuită după 50 de ani. Societatea Regală de Chimie. Recuperat de pe: chemistryworld.com
- Wikipedia. (2019). Fluor. Recuperat de pe: en.wikipedia.org
- Centrul Național pentru Informații despre Biotehnologie. (2019). Fluor. Baza de date PubChem. CID = 24524. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Dr. Doug Stewart. (2019). Fapte despre elementele fluorurate. Chemicool. Recuperat de pe: chemicool.com
- Batul Nafisa Baxamusa. (2018, 21 februarie). Utilizările surprinzător de comune ale fluorului extrem de reactiv. Recuperat de pe: sciencestruck.com
- Paola Opazo Sáez. (04 februarie 2019). Fluor în pasta de dinți: este bun sau rău pentru sănătatea ta? Recuperat de pe: nacionfarma.com
- Karl Christe și Stefan Schneider. (08 mai 2019). Fluor: element chimic. Encyclopædia Britannica. Recuperat de pe: britannica.com
- Lenntech B.V. (2019). Tabel periodic: oxigen. Recuperat de pe: lenntech.com
- Gagnon Steve. (s.f.). Elementul fluor. Jefferson Lab. Recuperat de pe: education.jlab.org
- Echipa American Cancer Society pentru conținut medical și editorial. (2015, 28 iulie). Fluorizarea apei și riscul de cancer. Recuperat de pe: cancer.org


Nimeni nu a comentat acest articol încă.