
Structura fluorurii de litiu, proprietăți, obținere, utilizări

fluorură de litiu este un solid anorganic a cărui formulă chimică este LiF. Este alcătuit din ioni Li+ și F- care sunt legate printr-o legătură ionică. Se găsește în cantități mici în diferite minerale, în special în silicați, cum ar fi lepidolitul, în apa de mare și în multe puțuri minerale..
A fost utilizat pe scară largă în dispozitivele optice datorită transparenței sale într-o gamă largă de lungimi de undă, de la spectrul infraroșu (IR) la ultraviolete UV, prin vizibil.

De asemenea, a fost folosit în dispozitive pentru detectarea radiațiilor periculoase în locuri de muncă în care oamenii sunt expuși la ele pentru o perioadă scurtă de timp. În plus, este folosit ca material pentru a topi aluminiu sau pentru a face ochelari pentru lentile sau ochelari și la fabricarea ceramicii..
Funcționează ca material de acoperire pentru componentele bateriilor litiu-ion și pentru a preveni pierderea inițială a încărcării din baterii.
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Punctul de topire
- 3.4 Punctul de fierbere
- 3.5 Densitate
- 3.6 Indicele de refracție
- 3.7 Solubilitate
- 3.8 Alte proprietăți
- 4 Colectare și locație
- 5 utilizări
- 5.1 În aplicații optice
- 5.2 În detectoarele de radiații ionizante sau periculoase
- 5.3 Ca material pentru preliterarea catodului bateriilor cu litiu
- 5.4 În diverse utilizări
- 6 Referințe
Structura
Fluorura de litiu este un compus ionic, adică format din uniunea cationului Li+ iar anionul F-. Forța care îi ține împreună este electrostatică și se numește legătură ionică..
Atunci când litiul se combină, acesta renunță la un electron în fluor, lăsându-i pe ambii într-o formă mai stabilă decât cea inițială, așa cum se explică mai jos.
Elementul litiu are următoarea configurație electronică: [He] 1sDouă 2s1 iar la transferul unui electron, structura electronică arată astfel: [He] 1sDouă care este mult mai stabil.
Elementul fluor a cărui configurație electronică este: [Ne] 1sDouă 2sDouă 2 P5, la acceptarea electronului rămâne sub forma [Ne] 1sDouă 2sDouă 2 P6, mai stabil.
Nomenclatură
- Fluorură de litiu
- Fluorolitiu
- Monofluorură de litiu
Proprietăți
Starea fizică
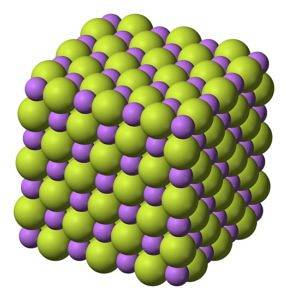
Solid alb, care cristalizează în structură cubică, precum clorura de sodiu NaCl.
Greutate moleculară
26 g / mol
Punct de topire
848,2 ºC
Punct de fierbere
1673 ºC, deși se volatilizează la 1100-1200 ºC
Densitate
2.640 g / cm3
Indicele de refracție
1,3915
Solubilitate
Ușor solubil în apă: 0,27 g / 100 g apă la 18 ° C; 0,134 g / 100 g la 25 ° C. Solubil în mediu acid. Insolubil în alcool.
Alte proprietăți
Vaporii săi prezintă specii dimerice (LiF)Două și trimeric (LiF)3. Cu acid fluorhidric HF formează bifluorură de litiu LiHFDouă; cu hidroxid de litiu formează o sare dublă LiF. LiOH.
Colectare și locație
Fluorura de litiu LiF poate fi obținută prin reacția dintre acidul fluorhidric HF și hidroxidul de litiu LiOH sau carbonatul de litiu LiDouăCO3.
Cu toate acestea, este prezent în cantități mici în anumite minerale, cum ar fi lepidolitul și în apa de mare..

Aplicații
În aplicațiile optice
LiF este utilizat sub formă de cristale compacte în spectrofotometre în infraroșu (IR) datorită dispersiei excelente pe care o prezintă în intervalul de lungimi de undă între 4000 și 1600 cm-1.
Cristale mari de LiF sunt obținute din soluții saturate ale acestei sări. Poate înlocui cristalele de fluorit naturale în diferite tipuri de aparate optice.
Cristalele mari și pure sunt utilizate în sistemele optice pentru ultraviolete (UV), lumina vizibilă și IR și în monocromatoarele cu raze X (0,03-0,38 nm).

De asemenea, este utilizat ca material de acoperire optic pentru regiunea UV datorită benzii sale optice largi, mai mare decât cea a altor fluoruri metalice..
Transparența sa în ultravioleta îndepărtată (90-200 nm) îl face ideal ca strat protector pentru oglinzile din aluminiu (Al). Oglinzile LiF / Al sunt utilizate în sistemele de telescop optic pentru aplicații în spațiu.
Aceste acoperiri sunt realizate prin depunerea fizică a vaporilor și depunerea stratului la nivel atomic..
În detectoarele de radiații ionizante sau periculoase
Fluorura de litiu a fost utilizată pe scară largă în detectoarele termoluminescente pentru radiații de fotoni, neutroni și particule β (beta)..
Detectoarele termoluminiscente economisesc energia radiației atunci când sunt expuse la aceasta. Mai târziu, când sunt încălzite, eliberează energia stocată sub formă de lumină..
Pentru această aplicație, LiF este în general dopat cu impurități de magneziu (Mg) și titan (Ti). Aceste impurități generează anumite niveluri de energie care acționează ca niște găuri în care sunt prinși electronii eliberați de radiații. Atunci când materialul este apoi încălzit, acești electroni revin la starea lor inițială de energie, emitând lumină.
Intensitatea luminii emise depinde direct de energia absorbită de material.
Detectoarele LiF termoluminiscente au fost testate cu succes pentru a măsura câmpuri complexe de radiații, cum ar fi cele prezente în Large Hadron Collider sau LHC. Collider mare de hadroni), situat în Organizația Europeană pentru Cercetare Nucleară, cunoscut sub numele de CERN (pentru acronimul său din franceză Conseil Européen pour la Recherche Nucléaire).
Radiațiile din experimentele efectuate în acest centru de cercetare prezintă hadroni, neutroni și electroni / pozitroni, printre alte tipuri de particule subatomice, toate putând fi detectate cu LiF.
Ca material pentru preliterarea catodului bateriilor cu litiu
LiF a fost testat cu succes sub formă de nanocompozite cu cobalt (Co) și fier (Fe) ca materiale pentru prelitizare. prelitiere) a materialului catodic al bateriilor litiu-ion.
În timpul primului ciclu de încărcare sau etapă de formare a unei baterii litiu-ion, electrolitul organic se descompune pentru a forma o fază solidă pe suprafața anodului..
Acest proces consumă litiu din catod și reduce energia cu 5 până la 20% din capacitatea totală a bateriei litiu-ion..
Din acest motiv, a fost investigată prelitierea electrochimică a catodului, care generează o extracție electrochimică a litiului din nanocompozit, care acționează ca un donator de litiu, evitând astfel consumul de litiu din catod..
Nanocompozitele LiF / Co și LiF / Fe au o capacitate mare de a dona litiu către catod, fiind ușor de sintetizat, stabil în condiții de mediu și procesare a bateriei.

În diverse utilizări
Fluorul de litiu este utilizat ca flux de sudură, în special aluminiu, și în acoperiri pentru tije de sudură. De asemenea, utilizat în celulele de reducere a aluminiului.
Este utilizat pe scară largă la fabricarea ochelarilor (cum ar fi lentilele) în care coeficientul de expansiune scade. Este, de asemenea, utilizat la fabricarea ceramicii. În plus, este utilizat la fabricarea emailurilor și a lacurilor vitroase..
LiF este o componentă a combustibililor pentru rachete și a combustibililor pentru anumite tipuri de reactoare..
LiF este, de asemenea, utilizat în diode emițătoare de lumină sau componente fotovoltaice, pentru injecția de electroni în straturi interne.
Referințe
- Cotton, F. Albert și Wilkinson, Geoffrey. (1980). Chimie anorganică avansată. A patra editie. John Wiley & Sons.
- S.U.A. Biblioteca Națională de Medicină. (2019). Fluorură de litiu. Recuperat de la: pubchem.ncbi.nlm.nih.gov.
- Obryk, B. și colab. (2008). Răspunsul diferitelor tipuri de detectoare de fluorură de litiu TL la câmpuri de radiații mixte de mare energie. Măsurători de radiații 43 (2008) 1144-1148. Recuperat de la sciencedirect.com.
- Sun, Y. și colab. (2016). Sinteza chimică in situ a fluorurii de litiu / nanocompozit metalic pentru prelelierea de mare capacitate a catodilor. Nano Letters 2016, 16, 2, 1497-1501. Recuperat de la pubs.acs.org.
- Hennessy, J. și Nikzad, S. (2018). Depunerea stratului atomic de acoperiri optice cu fluorură de litiu pentru ultraviolete. Anorganici 2018, 6, 46. Recuperat de pe mdpi.com.



Nimeni nu a comentat acest articol încă.