
Etape, funcții și inhibitori de fosforilare oxidativă
fosforilarea oxidativă este un proces în care moleculele ATP sunt sintetizate din ADP și Peu (fosfat anorganic). Acest mecanism este realizat de bacterii și celule eucariote. În celulele eucariote, fosforilarea are loc în matricea mitocondrială a celulelor non-fotosintetice.
Producția de ATP este condusă de transferul de electroni din coenzimele NADH sau FADHDouă la ODouă. Acest proces reprezintă cea mai mare producție de energie din celulă și este derivat din descompunerea carbohidraților și a grăsimilor..
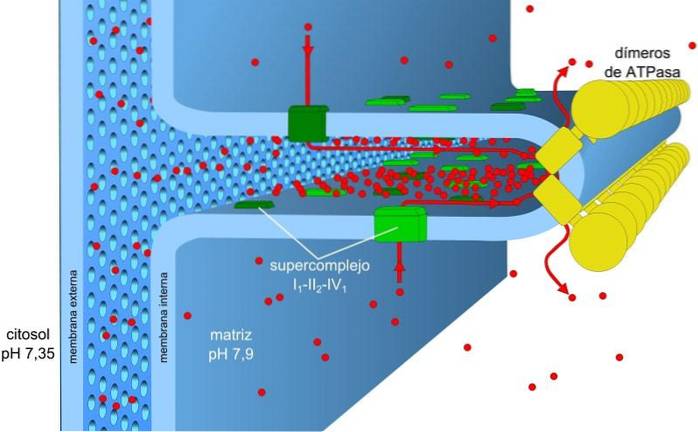
Energia stocată în gradienții de încărcare și pH, cunoscută și sub numele de forță motrice a protonului, permite ca acest proces să aibă loc. Gradientul de protoni generat face ca partea exterioară a membranei să aibă o sarcină pozitivă datorită concentrației de protoni (H+) iar matricea mitocondrială este negativă.
Indice articol
- 1 Unde apare fosforilarea oxidativă?
- 1.1 Centrală electrică celulară
- 2 Etape
- 2.1 Lanțul de transport al electronilor
- 2.2 Succinate CoQ reductaza
- 2.3 Cuplare sau transducție de energie
- 2.4 Cuplarea chimiosmotică
- 2.5 Sinteza ATP
- 3 Produse
- 4 Funcții
- 5 Controlul fosforilării oxidative
- 5.1 Controlul coordonat al producției de ATP
- 5.2 Controlul de către acceptor
- 5.3 Agenți de decuplare
- 5.4 Inhibitori
- 6 Referințe
Unde apare fosforilarea oxidativă?
Procesele de transport de electroni și fosforilarea oxidativă sunt asociate cu o membrană. La procariote aceste mecanisme sunt efectuate prin membrana plasmatică. În celulele eucariote se asociază cu membrana mitocondrială.
Numărul de mitocondrii găsite în celule variază în funcție de tipul de celulă. De exemplu, la mamifere, eritrocitelor le lipsește aceste organite, în timp ce alte tipuri de celule, cum ar fi celulele musculare, pot avea până la milioane de ele..
Membrana mitocondrială este formată dintr-o membrană exterioară simplă, o membrană internă ceva mai complexă și între ele spațiul intermembranar, unde se află multe enzime dependente de ATP.
Membrana exterioară conține o proteină numită porină care formează canalele pentru difuzia simplă a moleculelor mici. Această membrană este responsabilă pentru menținerea structurii și formei mitocondriilor.
Membrana interioară are o densitate mai mare și este bogată în proteine. De asemenea, este impermeabil pentru molecule și ioni, astfel încât, pentru a-l traversa, au nevoie de proteine intermembranare pentru a le transporta..
În interiorul matricei, pliurile membranei interioare se extind, formând creste care îi permit să aibă o suprafață mare într-un volum mic.
Centrală celulară
Mitocondriunea este considerată a fi producătorul central de energie celulară. Conține enzimele implicate în procesele ciclului acidului citric, oxidarea acizilor grași și enzimele redox și proteinele pentru transportul electronilor și fosforilarea ADP.
Gradientul concentrației de protoni (gradientul pH-ului) și gradientul de încărcare sau potențialul electric din membrana interioară a mitocondriilor sunt responsabili de forța motrice a protonului. Permeabilitatea redusă a membranei interioare pentru ioni (alta decât H+) permite mitocondriilor să aibă un gradient de tensiune stabil.
Transportul electronic, pomparea protonului și obținerea ATP au loc simultan în mitocondrii, datorită forței motrice a protonului. Gradientul de pH menține condițiile acide în intermembrană și matricea mitocondrială cu condiții alcaline.
Pentru fiecare doi electroni transferați la ODouă aproximativ 10 protoni sunt pompați prin membrană, creând un gradient electrochimic. Energia eliberată în acest proces este produsă treptat prin trecerea electronilor prin lanțul de transport.
Etape
Energia eliberată în timpul reacțiilor de oxidare-reducere ale NADH și FADHDouă este considerabil ridicat (în jur de 53 kcal / mol pentru fiecare pereche de electroni), deci pentru a fi utilizat la fabricarea moleculelor de ATP, acesta trebuie produs treptat odată cu trecerea electronilor prin transportoare.
Acestea sunt organizate în patru complexe situate pe membrana mitocondrială internă. Cuplarea acestor reacții la sinteza ATP se realizează într-un al cincilea complex.
Lanțul de transport al electronilor
NADH transferă o pereche de electroni care intră în complexul I al lanțului de transport al electronilor. Electronii sunt transferați la mononucleotida flavinei, apoi la ubiquinonă (coenzima Q) printr-un transportor fier-sulf. Acest proces eliberează o cantitate mare de energie (16,6 kcal / mol).
Ubiquinonă transportă electroni prin membrană la complexul III. În acest complex, electronii trec prin citocromii b și c1 datorită unui transportor fier-sulf.
Electronii trec de la complexul III la complexul IV (citocrom c oxidază), transferați unul câte unul în citocromul c (proteină de membrană periferică). În complexul IV, electronii trec printr-o pereche de ioni de cupru (CulaDouă+), urmat de citocromul cla, apoi la o altă pereche de ioni de cupru (CubDouă+) și de la acesta la citocromul a3.
În cele din urmă, electronii sunt transferați la ODouă care este ultimul acceptor și formează o moleculă de apă (HDouăO) pentru fiecare pereche de electroni primiți. Trecerea electronilor de la complexul IV la O.Două De asemenea, generează o cantitate mare de energie liberă (25,8 kcal / mol).
Succinate CoQ reductaza
Complexul II (succinat CoQ reductaza) primește o pereche de electroni din ciclul acidului citric, prin oxidarea unei molecule de succinat în fumarat. Acești electroni sunt transferați în FAD, trecând apoi printr-o grupare fier-sulf, la ubiquinonă. Din această coenzimă trec la complexul III și urmează traseul descris anterior.
Energia eliberată în reacția de transfer de electroni către FAD nu este suficientă pentru a conduce protonii prin membrană, deci nu este generată nicio forță motrice a protonului în acest pas al lanțului și, în consecință, FADH produce mai puțin H+ că NADH.
Cuplarea sau transducția energiei
Energia generată în procesul de transport al electronilor descris anterior trebuie să poată fi utilizată pentru producerea de ATP, o reacție catalizată de enzima ATP sintază sau complexul V. Conservarea acestei energii este cunoscută sub numele de cuplare a energiei, iar mecanismul a fost greu de caracterizat.
Au fost descrise mai multe ipoteze pentru a descrie această transducție de energie. Cea mai bine acceptată este ipoteza cuplării chemiosmotice, descrisă mai jos..
Cuplaj chimios
Acest mecanism propune că energia utilizată pentru sinteza ATP provine dintr-un gradient de protoni din membranele celulare. Acest proces intervine în mitocondrii, cloroplaste și bacterii și este legat de transportul electronilor.
Complexele I și IV ale transportului de electroni acționează ca pompe de protoni. Acestea suferă modificări conformaționale care le permit să pompeze protoni în spațiul intermembranar. În complexul IV, pentru fiecare pereche de electroni, doi protoni sunt pompați din membrană și încă doi rămân în matrice, formând HDouăSAU.
Ubiquinona din complexul III acceptă protoni din complexele I și II și îi eliberează în exteriorul membranei. Complexele I și III permit fiecare trecerea a patru protoni pentru fiecare pereche de electroni transportați.
Matricea mitocondrială are o concentrație scăzută de protoni și un potențial electric negativ, în timp ce spațiul intermembranar prezintă condițiile inverse. Fluxul de protoni prin această membrană reprezintă gradientul electrochimic care stochează energia necesară (± 5 kcal / mol per proton) pentru sinteza ATP..
Sinteza ATP
Enzima ATP sintetaza este al cincilea complex implicat în fosforilarea oxidativă. Este responsabil de valorificarea energiei gradientului electrochimic pentru a forma ATP.
Această proteină transmembranară este formată din două componente: F0 și F1. Componenta F0 permite revenirea protonilor la matricea mitocondrială funcționând ca un canal și F1 catalizează sinteza ATP de către ADP și Peu, folosind energia revenirii respective.
Procesul de sinteză ATP necesită o schimbare structurală în F1 și ansamblul componentelor F0 și F1. Translocarea protonului prin F0 provoacă modificări conformaționale în trei subunități ale lui F1, permițându-i să acționeze ca un motor de rotație, dirijând formarea ATP.
Subunitatea responsabilă de legarea ADP cu Peu trece de la o stare slabă (L) la una activă (T). Când se formează ATP, o a doua subunitate intră într-o stare deschisă (O) care permite eliberarea acestei molecule. După eliberarea ATP, această subunitate trece de la starea deschisă la starea inactivă (L).
Molecule ADP și Peu legați-vă de o subunitate care a trecut de la o stare O la o stare L.
Produse
Lanțul de transport al electronilor și fosforilarea produc molecule de ATP. Oxidarea NADH produce aproximativ 52,12 kcal / mol (218 kJ / mol) de energie liberă.
Reacția generală pentru oxidarea NADH este:
NADH + 1⁄2 ODouă +H+ ↔ HDouăO + NAD+
Transferul de electroni de la NADH și FADHDouă are loc prin diferite complexe, permițând schimbarea energiei libere ΔG ° să fie împărțită în „pachete” de energie mai mici, care sunt cuplate la sinteza ATP.
Oxidarea unei molecule de NADH generează sinteza a trei molecule de ATP. În timp ce oxidarea unei molecule FADHDouă cupluri la sinteza a două ATP-uri.
Aceste coenzime provin din procesele ciclului de glicoliză și acid citric. Pentru fiecare moleculă de glucoză degradată, acestea ajung să producă 36 sau 38 de molecule de ATP, în funcție de localizarea celulelor. 36 ATP este produs în creier și mușchiul scheletic, în timp ce 38 ATP este produs în țesutul muscular..
Caracteristici
Toate organismele, unicelulare și multicelulare, au nevoie de energie minimă în celulele lor pentru a efectua procesele din ele și, la rândul lor, mențin funcțiile vitale în întregul organism..
Procesele metabolice necesită energie pentru a avea loc. Cea mai mare parte a energiei utilizabile este obținută din descompunerea carbohidraților și a grăsimilor. Această energie este derivată din procesul de fosforilare oxidativă.
Controlul fosforilării oxidative
Rata de utilizare a ATP în celule controlează sinteza acesteia și, la rândul său, datorită cuplării fosforilării oxidative cu lanțul de transport al electronilor, reglează, de asemenea, rata de transport a electronilor..
Fosforilarea oxidativă are un control strict care asigură faptul că ATP nu este generat mai repede decât este consumat. Există anumite etape în procesul de transport al electronilor și de fosforilare cuplată care reglează rata producției de energie..
Controlul coordonat al producției de ATP
Principalele căi de producție a energiei (ATP celular) sunt glicoliza, ciclul acidului citric și fosforilarea oxidativă. Controlul coordonat al acestor trei procese reglementează sinteza ATP.
Controlul fosforilării prin raportul de acțiune în masă al ATP depinde de contribuția precisă a electronilor în lanțul de transport. La rândul său, acest lucru depinde de [NADH] / [NAD+] care este menținută ridicată de acțiunea glicolizei și a ciclului acidului citric.
Acest control coordonat se efectuează prin reglarea punctelor de control ale glicolizei (PFK inhibat de citrat) și a ciclului acidului citric (piruvat dehidrogenază, citrat tapeaz, izocitrat dehidrogenază și α-cetoglutarat dehidrogenază)..
Control de către acceptor
Complexul IV (citocrom c oxidază) este o enzimă reglementată de unul dintre substraturile sale, adică activitatea sa este controlată de citocromul c (cDouă+), care la rândul său este în echilibru cu raportul de concentrație dintre [NADH] / [NAD+] și raportul de acțiune în masă [ATP] / [ADP] + [Peu].
Cu cât este mai mare raportul [NADH] / [NAD+] și coborâți [ATP] / [ADP] + [Peu], cu atât concentrația de citocrom este mai mare [cDouă+] și cu cât activitatea complexului IV este mai mare. Acest lucru este interpretat, de exemplu, dacă comparăm organismele cu diferite activități de odihnă și activitate ridicată.
La un individ cu activitate fizică ridicată, consumul de ATP și, prin urmare, hidroliza acestuia la ADP + Peu va fi foarte mare, generând o diferență în raportul de acțiune de masă care determină o creștere în [cDouă+] și deci o creștere a sintezei ATP. La un individ în repaus, apare situația inversă.
În cele din urmă, rata fosforilării oxidative crește odată cu concentrația de ADP în mitocondrii. Această concentrație depinde de translocatorii ADP-ATP responsabili de transportul nucleotidelor de adenină și Peu de la citosol la matricea mitocondrială.
Agenți de decuplare
Fosforilarea oxidativă este influențată de anumiți agenți chimici, care permit transportul electronilor să continue fără a se produce fosforilarea ADP, decuplând producția și conservarea energiei.
Acești agenți stimulează rata de consum de oxigen a mitocondriilor în absența ADP, provocând, de asemenea, o creștere a hidrolizei ATP. Aceștia acționează prin eliminarea unui intermediar sau prin ruperea unei stări de energie a lanțului de transport al electronilor.
2,4-dinitrofenol, un acid slab care trece prin membranele mitocondriale, este responsabil pentru disiparea gradientului de protoni, deoarece aceștia se leagă de aceștia pe partea acidă și îi eliberează pe partea bazică.
Acest compus a fost folosit ca „pastilă dietetică”, deoarece s-a constatat că produce o creștere a respirației, deci o creștere a ratei metabolice și a pierderii în greutate asociate. Cu toate acestea, s-a arătat că efectul său negativ poate provoca chiar moartea.
Disiparea gradientului de protoni produce căldură. Celulele din țesutul adipos maro utilizează decuplarea controlată hormonal pentru a produce căldură. Mamiferele hibernante și nou-născuții cărora le lipsește părul constau din acest țesut care servește ca un fel de pătură termică..
Inhibitori
Compușii sau agenții inhibitori ambii împiedică consumul de ODouă (transportul electronilor), cum ar fi fosforilarea oxidativă asociată. Acești agenți previn formarea ATP prin utilizarea energiei produse în transportul electronic. Prin urmare, lanțul de transport se oprește deoarece consumul de energie menționat nu este disponibil..
Antibioticul oligomicină funcționează ca un inhibitor al fosforilării la multe bacterii, prevenind stimularea ADP la sinteza ATP.
Există, de asemenea, agenți ionofori, care formează complexe liposolubile cu cationi precum K+ și Na+, și trec prin membrana mitocondrială cu acești cationi. Mitocondriile folosesc apoi energia produsă în transportul de electroni pentru a pompa cationii în loc să sintetizeze ATP..
Referințe
- Alberts, B., Bray, D., Hopkin, K., Johnson, A., Lewis, J., Raff, M., Roberts, K. și Walter, P. (2004). Biologie celulară esențială. New York: Garland Science.
- Cooper, G. M., Hausman, R. E. și Wright, N. (2010). Celula. (pp. 397-402). Marban.
- Devlin, T. M. (1992). Manual de biochimie: cu corelații clinice. John Wiley & Sons, Inc..
- Garrett, R. H. și Grisham, C. M. (2008). Biochimie. Thomson Brooks / Cole.
- Lodish, H., Darnell, J. E., Berk, A., Kaiser, C. A., Krieger, M., Scott, M. P. și Matsudaira, P. (2008). Biologia celulelor moleculare. Macmillan.
- Nelson, D. L. și Cox, M. M. (2006). Principiile Lehninger de biochimie Ediția a IV-a. Ed Omega. Barcelona.
- Voet, D. și Voet, J. G. (2006). Biochimie. Panamerican Medical Ed..



Nimeni nu a comentat acest articol încă.