
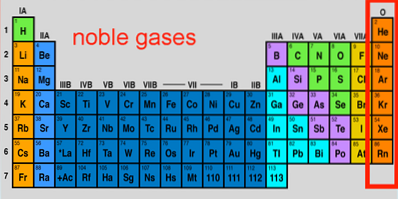
Caracteristici ale gazelor nobile, configurație, reacții, utilizări

gaze nobile Sunt un set de elemente care se regăsesc în grupa 18 a tabelului periodic. De-a lungul anilor, acestea au fost numite și gaze rare sau inerte, ambele fiind inexacte; unele dintre ele sunt foarte abundente în afara și în interiorul planetei Pământ și sunt, de asemenea, capabile, în condiții extreme, să reacționeze.
Cele șapte elemente ale sale alcătuiesc probabil cel mai unic grup din tabelul periodic, ale cărui proprietăți și reactivități reduse sunt la fel de impresionante ca și cele ale metalelor nobile. Printre ele pară cel mai inert element (neon), al doilea cel mai abundent din Cosmos (heliu) și cel mai greu și mai instabil (oganeson).

Gazele nobile sunt cele mai reci substanțe din natură; rezista la temperaturi foarte scăzute înainte de condensare. Chiar și mai dificilă este înghețarea, deoarece forțele sale intermoleculare bazate pe împrăștierea londoneză și polarizabilitatea atomilor săi sunt prea slabe pentru a le menține abia coezive într-un cristal..
Datorită reactivității lor scăzute, acestea sunt gaze relativ sigure de depozitat și nu prezintă prea multe riscuri. Cu toate acestea, ele pot deplasa oxigenul din plămâni și pot provoca sufocare dacă sunt inhalate excesiv. Pe de altă parte, doi dintre membrii săi sunt elemente extrem de radioactive și, prin urmare, fatale pentru sănătate..
Reactivitatea scăzută a gazelor nobile este, de asemenea, utilizată pentru a asigura reacțiile cu o atmosferă inertă; astfel încât niciun reactiv sau produs nu riscă să se oxideze și să afecteze performanța sintezei. Acest lucru favorizează, de asemenea, procesele de sudare cu arc electric..
Pe de altă parte, în starea lor lichidă, sunt agenți frigorifici criogeni excelenți, care garantează cele mai scăzute temperaturi, esențiale pentru funcționarea corectă a echipamentelor extrem de energice sau pentru ca unele materiale să atingă stări de supraconductivitate.
Indice articol
- 1 Caracteristicile gazelor nobile
- 2 Cele 7 gaze nobile
- 3 Configurare electronică
- 4 Polarizabilitatea
- 5 Reacții
- 5.1 Heliu și neon
- 5.2 Argon și cripton
- 5.3 Xenon și radon
- 6 Producție
- 6.1 Lichidarea aerului
- 6.2 Distilarea gazelor naturale și a mineralelor radioactive
- 7 Pericole
- 8 utilizări
- 8.1 Industrie
- 8.2 Baloane și rezervoare de respirație
- 8.3 Medicină
- 8.4 Altele
- 9 Referințe
Caracteristici ale gazelor nobile
Poate că gazele nobile sunt elementele care împărtășesc cele mai multe calități în comun, atât fizice, cât și chimice. Principalele sale caracteristici sunt:
- Toate sunt incolore, inodore și fără gust; dar când sunt închise în fiole la presiuni scăzute și primesc un șoc electric, se ionizează și emit lumini colorate (imaginea de sus).
- Fiecare gaz nobil are propria lumină și spectru.
- Sunt specii monatomice, singurele din tabelul periodic care pot exista în stările lor fizice respective fără participarea legăturilor chimice (deoarece metalele sunt unite prin legături metalice). Prin urmare, sunt perfecte pentru studierea proprietăților gazelor, deoarece se adaptează foarte bine la modelul sferic al unui gaz ideal..
- Acestea sunt în general elementele cu cele mai scăzute puncte de topire și fierbere; atât de mult, încât heliul nu poate chiar cristaliza la zero absolut fără o creștere a presiunii.
- Dintre toate elementele, acestea sunt cele mai puțin reactive, chiar mai puțin decât metalele nobile.
- Energiile lor de ionizare sunt cele mai mari, precum și electronegativitățile lor, presupunând că formează legături pur covalente..
- Razele sale atomice sunt, de asemenea, cele mai mici, deoarece se află la capetele din dreapta fiecărei perioade..
Cele 7 gaze nobile
Cele șapte gaze nobile sunt, de sus în jos, descendente prin grupa 18 din tabelul periodic:
-Heliu, El
-Neon, Ne

-Argon, Ar
-Krypton, Kr
-Xenon, Xe

-Radon, Rn
-Oganeson, Og
Toate acestea, cu excepția oganesonului instabil și artificial, au fost studiate pentru proprietățile lor fizice și chimice. Oganesonul, datorită masei sale atomice mari, se crede că nu este nici măcar un gaz, ci un lichid nobil sau solid. Se știe puțin despre radon, datorită radioactivității sale, în raport cu heliul sau argonul.
Configurare electronică
S-a spus că gazele nobile au carcasa de valență complet umplută. Atât de mult, încât configurațiile lor electronice sunt utilizate pentru a simplifica pe cel al altor elemente folosind simbolurile lor între paranteze drepte ([He], [Ne], [Ar] etc.). Configurațiile sale electronice sunt:
-Heliu: 1sDouă, [El] (2 electroni)
-Neon: 1sDouă2sDouă2 P6, [Ne] (10 electroni)
-Argon: 1sDouă2sDouă2 P63sDouă3p6, [Ar] (18 electroni)
-Krypton: 1sDouă2sDouă2 P63sDouă3p63d104sDouă4p6, [Kr] (36 electroni)
-Xenon: 1sDouă2sDouă2 P63sDouă3p63d104sDouă4p64d105sDouă5 p6, [Xe] (54 de electroni)
-Radon: 1sDouă2sDouă2 P63sDouă3p63d104sDouă4p64d104f145sDouă5 p65 zile106sDouă6p6, [Rn] (86 de electroni)
Important este să nu-i amintim, ci să detaliem că se termină în nsDouănp6: octetul de valență. De asemenea, se apreciază că atomii săi au mulți electroni, care datorită forței nucleare eficiente mari se găsesc într-un volum mai mic comparativ cu cel al celorlalte elemente; adică razele lor atomice sunt mai mici.
Prin urmare, razele lor atomice dense din punct de vedere electronic prezintă o caracteristică chimică pe care o împărtășesc toate gazele nobile: sunt greu de polarizat..
Polarizabilitatea
Gazele nobile pot fi imaginate ca sfere de nori de electroni. În timp ce coborâți prin grupul 18, razele sale cresc și, în același mod, distanța care separă nucleul de electronii de valență (cei din nsDouănp6).
Acești electroni, simțind o forță mai puțin atractivă din partea nucleului, se pot mișca mai liber; sferele se deformează mai ușor cu atât sunt mai voluminoase. Ca o consecință a unor astfel de mișcări, apar regiuni cu densități mici și mari de electroni: polii δ + și δ-.
Când atomul unui gaz nobil este polarizat, acesta devine un dipol instantaneu capabil să inducă altul atomului vecin; adică ne confruntăm cu forțele dispersive ale Londrei.
De aceea, forțele intermoleculare cresc de la heliu la radon, reflectate în creșterea punctelor lor de fierbere; și nu numai asta, ci și reactivitățile lor sunt crescute.
Pe măsură ce atomii devin mai polarizați, există o posibilitate mai mare ca electronii lor de valență să participe la reacții chimice, după care se generează compuși de gaze nobile..
Reacții
Heliu și neon
Dintre gazele nobile, cele mai puțin reactive sunt heliul și neonul. De fapt, neonul este cel mai inert element dintre toate, chiar dacă electronegativitatea sa (din formarea legăturilor covalente) o depășește pe cea a fluorului.
Niciunul dintre compușii săi nu este cunoscut în condiții terestre; Cu toate acestea, în Cosmos, existența ionului molecular HeH este destul de probabilă+. La fel, atunci când sunt excitați electronic, sunt capabili să interacționeze cu atomi gazoși și să formeze molecule neutre de scurtă durată numite excimeri; precum HeNe, CsNe și NeDouă.
Pe de altă parte, deși nu sunt considerați compuși într-un sens formal, atomii de He și Ne pot da naștere la molecule Van der Walls; adică compuși care sunt ținuți „împreună” pur și simplu de forțe dispersive. De exemplu: Ag3El, HeCO, HeIDouă, CF4Ne, Ne3ClDouă și NeBeCO3.
De asemenea, astfel de molecule Van der Walls pot exista datorită interacțiunilor slabe de dipol induse de ioni; de exemplu: Na+eu am8, Rb+El, Cu+Ne3 și Cu+Ne12. Rețineți că este chiar posibil ca aceste molecule să devină aglomerate de atomi: grupuri.
Și în cele din urmă, atomii He și Ne pot fi „prinși” sau intercalați în complexe endoedrice de fulereni sau clatrați, fără a reacționa; de exemplu: [email protected]60, (NDouă)6Ne7, El (HDouăSAU)6 și Ne • NH4Fe (HCOO)3.
Argon și cripton
Gazele nobile argon și criptonul, deoarece sunt mai polarizabile, tind să prezinte mai mulți „compuși” decât heliul și neonul. Cu toate acestea, o parte dintre ele sunt mai stabile și caracterizabile, deoarece au o durată de viață mai lungă. Printre unii dintre ei se numără HArF și ionul molecular ArH+, prezent în nebuloase prin acțiunea razelor cosmice.
De la cripton începe posibilitatea de a obține compuși în condiții extreme, dar durabile. Acest gaz reacționează cu fluor conform următoarei ecuații chimice:
Kr + FDouă → KrFDouă
Rețineți că kriptonul dobândește un număr de oxidare de +2 (KrDouă+) datorită fluorului. KrFDouă de fapt poate fi sintetizat în cantități comercializabile ca agent de oxidare și fluorurare.
Argonul și criptonul pot stabili un repertoriu larg de clatrați, complexe endoedrice, molecule Van der Walls și unii compuși care așteaptă descoperirea după existența lor prezisă..
Xenon și radon
Xenonul este, printre gazele nobile, regele reactivității. Formează compușii cu adevărat stabili, comercializabili și caracterizabili. De fapt, reactivitatea sa seamănă cu cea a oxigenului în condițiile adecvate..
Primul său compus sintetizat a fost „XePtF6", În 1962 de Neil Bartlett. Această sare, de fapt, conform literaturii, consta dintr-un amestec complex de alte săruri fluorurate de xenon și platină.
Cu toate acestea, acest lucru a fost mai mult decât suficient pentru a demonstra afinitatea dintre xenon și fluor. Printre acești compuși avem: XeFDouă, XeF4, XeF6 și [XeF]+[PtF5]-. Când XeF6 se dizolvă în apă, generează un oxid:
XeF6 + 3 HDouăO → XeO3 + 6 HF
Acest XeO3 poate proveni specia cunoscută sub numele de xenatos (HXeO4-) sau acid xenic (HDouăXeO4). Xenați disproporționați față de perxenați (XeO64-); iar dacă mediul este apoi acidificat, în acid peroxenic (H4XeO6), care este deshidratat în tetroxid de xenon (XeO4):
H4XeO6 → 2 HDouăO + XeO4
Radonul ar trebui să fie cel mai reactiv dintre gazele nobile; Dar este atât de radioactiv încât abia mai are timp să reacționeze înainte de a se dezintegra. Singurii compuși care au fost sintetizați în totalitate sunt fluorura sa (RnFDouă) și oxid (RnO3).
Producție
Lichidarea aerului
Gazele nobile devin din ce în ce mai abundente în Univers pe măsură ce coborâm prin grupa 18. Cu toate acestea, în atmosferă heliul este rar, deoarece câmpul gravitațional al Pământului nu îl poate reține, spre deosebire de alte gaze. De aceea nu a fost detectat în aer ci în Soare.
Pe de altă parte, în aer există cantități notabile de argon, care provin din degradarea radioactivă a radioizotopului 40K. Aerul este cea mai importantă sursă naturală de argon, neon, kripton și xenon de pe planetă.
Pentru a le produce, aerul trebuie mai întâi lichefiat astfel încât să se condenseze într-un lichid. Apoi, acest lichid suferă o distilare fracționată, separând astfel fiecare dintre componentele amestecului său (NDouă, SAUDouă, CODouă, Ar etc.).
În funcție de cât de scăzută este temperatura și abundența gazului, prețurile acestuia cresc, clasificând xenonul drept cel mai scump, în timp ce heliul ca fiind cel mai ieftin..
Distilarea gazelor naturale și a mineralelor radioactive
Heliul, la rândul său, se obține dintr-o altă distilare fracționată; dar nu din aer, ci din gaz natural, îmbogățit cu heliu datorită eliberării particulelor alfa din mineralele radioactive toriu și uraniu.
La fel, radonul se „naște” din dezintegrarea radioactivă a radiului în mineralele sale respective; dar datorită abundenței lor mai mici și a timpului de înjumătățire scurt al atomilor de Rn, abundența lor este de râs în comparație cu cea a congenerilor lor (celelalte gaze nobile).
Și în cele din urmă, oganesonul este un „gaz” nobil extrem de radioactiv, ultramassic, creat de om, care poate exista doar pe scurt în condiții controlate în cadrul unui laborator..
Pericole
Principalul risc al gazelor nobile este acela că limitează utilizarea oxigenului de către om, mai ales atunci când se produce o atmosferă cu o concentrație ridicată a acestora. De aceea nu este recomandat să le inhalați excesiv..
În Statele Unite, s-a detectat o concentrație mare de radon în solurile bogate în uraniu, care datorită caracteristicilor sale radioactive ar putea reprezenta un risc pentru sănătate.
Aplicații
Industrie
Heliul și argonul sunt folosite pentru a crea o atmosferă inertă pentru protecție în timpul sudării și tăierii. În plus, acestea sunt utilizate la fabricarea semiconductoarelor din siliciu. Heliul este utilizat ca gaz de umplere în termometre.
Argonul, în combinație cu azotul, este utilizat la fabricarea lămpilor cu incandescență. Kryptonul amestecat cu halogeni, cum ar fi bromul și iodul, este utilizat în lămpile cu descărcare. Neonul este utilizat în semne luminoase, amestecat cu fosfor și alte gaze pentru a-și nuanța culoarea roșie.
Xenonul este utilizat în lămpile cu arc care emit lumină care seamănă cu lumina zilei, care sunt utilizate în farurile și proiectoarele auto. Gazele nobile sunt amestecate cu halogeni pentru a produce ArF, KrF sau XeCl, care sunt utilizate în producția de lasere excimer..
Acest tip de laser produce lumină ultravioletă cu unde scurte care produce imagini de înaltă precizie și este utilizat la fabricarea circuitelor integrate. Heliul și neonul sunt utilizate ca gaze frigorifice criogenice.
Baloane și rezervoare de respirație
Heliul este utilizat ca înlocuitor al azotului în amestecul de gaze respiratorii, datorită solubilității sale scăzute în organism. Acest lucru evită formarea de bule în timpul fazei de decompresie în timpul ascensiunii, pe lângă eliminarea narcozei cu azot.
Heliul a înlocuit hidrogenul ca gaz care permite ridicarea dirijabilelor și a baloanelor de aer cald, deoarece este un gaz ușor și necombustibil..
Medicament
Heliul este utilizat la fabricarea magneților supraconductori utilizați în echipamentele de rezonanță magnetică nucleară: un instrument cu aplicații multiple în medicină.
Krypton este utilizat în lămpile cu halogen utilizate în chirurgia cu ochi cu laser și angioplastie. Heliul este utilizat pentru a facilita respirația la pacienții astmatici.
Xenonul este utilizat ca anestezic datorită solubilității sale ridicate a lipidelor și se crede că este anestezicul viitorului. Xenonul este, de asemenea, utilizat în imagistica medicală pulmonară.
Radonul, un gaz nobil radioactiv, este utilizat în radioterapie pentru unele tipuri de cancer.
Alții
Argonul este utilizat în sinteza compușilor care substituie azotul ca atmosferă inertă. Heliul este utilizat ca gaz purtător în cromatografia de gaze, precum și în contoare Geiger pentru a măsura radiațiile.
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Helmenstine, Anne Marie, dr. (06 iunie 2019). Proprietăți, utilizări și surse ale gazelor nobile. Recuperat de pe: thoughtco.com
- Wikipedia. (2019). Gaz nobil. Recuperat de pe: en.wikipedia.org
- Philip Ball. (18 ianuarie 2012). Chimie imposibilă: obligarea gazelor nobile să funcționeze. Recuperat de pe: newscientist.com
- Profesorul Patricia Shapley. (2011). Chimia gazelor nobile. Recuperat de la: butane.chem.uiuc.edu
- Gary J. Schrobilgen. (28 februarie 2019). Gaz nobil. Encyclopædia Britannica. Recuperat de pe: britannica.com



Nimeni nu a comentat acest articol încă.