
Caracteristicile grupului carbonil, proprietăți, nomenclatură, reactivitate
grupa carbonil Este un grup funcțional organic și oxigenat care seamănă cu molecula gazoasă de monoxid de carbon. Este reprezentat ca C = O și, deși este considerat organic, poate fi găsit și în compuși anorganici; ca acid carbonic, HDouăCO3, sau în compuși organometalici cu CO ca liant.
Cu toate acestea, în chimia carbonului, a vieții, a biochimiei și a altor ramuri științifice similare, acest grup se remarcă prin importanța sa enormă. Dacă nu ar fi el, multe molecule nu ar putea interacționa cu apa; proteine, zaharuri, aminoacizi, grăsimi, acizi nucleici și alte biomolecule nu ar exista dacă nu ar fi pentru el.
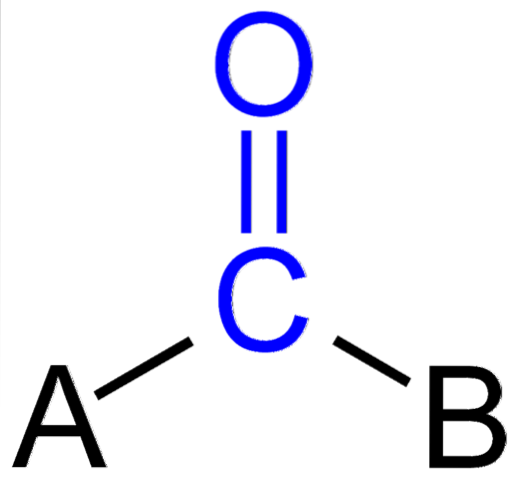
Imaginea de mai sus arată cum arată acest grup în scheletul general al unui compus. Rețineți că este evidențiat prin culoarea albastră și, dacă am elimina substituenții A și B (R sau R ', valabili la fel), ar rămâne o moleculă de monoxid de carbon. Prezența acestor substituenți definește un număr mare de molecule organice.
Dacă A și B sunt alți atomi decât carbonul, cum ar fi metalele sau elementele nemetalice, unul poate avea compuși organometalici sau respectiv anorganici. În cazul chimiei organice, substituenții A și B vor fi întotdeauna fie atomi de hidrogen, lanțuri de carbon, linii, cu sau fără ramificații, cicluri sau inele aromatice..
Acesta este modul în care începe să înțeleagă de ce gruparea carbonil este destul de comună pentru cei care studiază științele naturii sau sănătății; este peste tot și fără ea mecanismele moleculare care se întâmplă în celulele noastre nu s-ar produce.
Dacă relevanța sa ar putea fi rezumată, s-ar spune că contribuie la polaritate, aciditate și reactivitate la o moleculă. Acolo unde există o grupare carbonil, este mai mult decât probabil ca tocmai în acel moment molecula să poată suferi o transformare. Prin urmare, este un site strategic pentru a dezvolta sinteza organică prin oxidare sau atacuri nucleofile..
Indice articol
- 1 Caracteristicile și proprietățile grupării carbonil
- 1.1 Structuri de rezonanță
- 2 Nomenclatură
- 3 Reactivitate
- 3.1 Atac nucleofil
- 3.2 Reducere
- 3.3 Formarea acetalilor și cetalilor
- 4 tipuri
- 5 Cum să-l identificăm în aldehide și cetone
- 5.1 Identificare
- 6 Exemple principale
- 7 Referințe
Caracteristicile și proprietățile grupării carbonil
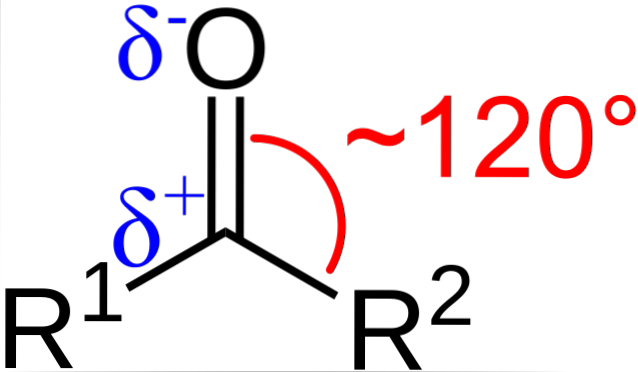
Care sunt caracteristicile structurale și electronice ale grupării carbonil? Mai sus se poate vedea, folosind acum literele R1 și RDouă în loc de A și B, există un unghi de 120 ° C între substituenți și atomul de oxigen; adică geometria din jurul acestui grup este un plan trigonal.
Pentru ca o astfel de geometrie să fie atomii de carbon și oxigen trebuie să aibă neapărat hibridizare chimică spDouă; astfel carbonul va avea trei sp orbitaliDouă pentru a forma legături covalente simple cu R1 și RDouă, și un orbital p pur pentru a stabili legătura dublă cu oxigenul.
Aceasta explică modul în care poate exista o legătură dublă C = O.
Dacă imaginea este observată, se va vedea, de asemenea, că oxigenul are o densitate mai mare de electroni, δ-, decât carbonul, δ +. Acest lucru se datorează faptului că oxigenul este mai electronegativ decât carbonul și, prin urmare, „îi fură” densitatea electronilor; și nu numai el, ci și substituenții R1 și RDouă.
În consecință, se generează un moment dipol permanent, care poate fi de magnitudine mai mare sau mai mică în funcție de structura moleculară. Oriunde există o grupare carbonil, vor exista momente dipolice.
Structuri de rezonanță
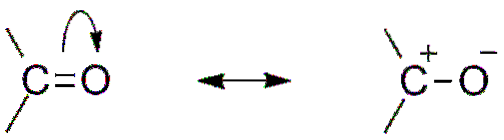
O altă consecință a electronegativității oxigenului este că în grupul carbonil există structuri de rezonanță care definesc un hibrid (combinația celor două structuri din imaginea superioară). Rețineți că perechea de electroni poate migra spre orbital p oxigen, care lasă atomul de carbon cu o sarcină parțială pozitivă; o carbocație.
Ambele structuri se succed constant, deci carbonul menține o deficiență constantă de electroni; adică, pentru cationii care îi sunt foarte aproape, vor experimenta repulsie electrostatică. Dar, dacă este un anion sau o specie capabilă să doneze electroni, veți simți o atracție puternică pentru acest carbon..
Apoi apare ceea ce este cunoscut sub numele de atac nucleofil, care va fi explicat într-o secțiune viitoare.
Nomenclatură
Când un compus are grupa C = O, se spune că este carbonil. Astfel, în funcție de natura compusului carbonilic, acesta are propriile reguli de nomenclatură.
Deși, indiferent de ce este, toți împărtășesc o regulă comună: C = O are prioritate în lanțul de carbon la listarea atomilor de carbon.
Aceasta înseamnă că, dacă există ramuri, atomi de halogen, grupări funcționale azotate, legături duble sau triple, niciuna dintre ele nu poate purta un număr de localizare mai mic decât C = O; de aceea, cel mai lung lanț începe să fie enumerat cât mai aproape posibil de gruparea carbonil.
Dacă, pe de altă parte, există mai mulți C = O în lanț și unul dintre ei face parte dintr-o grupă funcțională superioară, atunci gruparea carbonil va purta un localizator mai mare și va fi menționat ca un substituent oxo..
Și ce este această ierarhie? Următoarele, de la cel mai mare la cel mai mic:
-Acizi carboxilici, RCOOH
-Ester, RCOOR '
-Amida, RCONHDouă
-Aldehidă, RCOH (sau RCHO)
-Cetonă, RCOR
Înlocuind segmentele moleculare R și R ', o mulțime de compuși carbonilici sunt originari reprezentați de familiile de mai sus: acizi carboxilici, esteri, amide etc. Fiecare are asociată nomenclatura sa tradițională sau IUPAC..
Reactivitate
Atac nucleofil
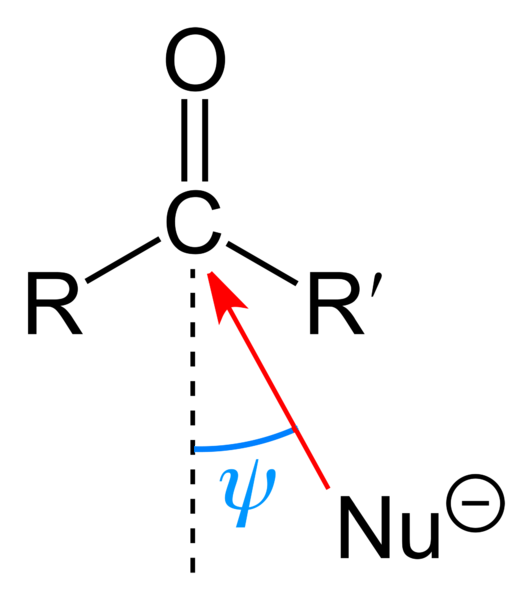
Imaginea superioară arată atacul nucleofil suferit de gruparea carbonil. Nucleofilul, Nu-, poate fi un anion sau o specie neutră cu perechi de electroni disponibili; cum ar fi amoniacul, NH3, de exemplu. Se uită exclusiv la carbon deoarece, conform structurilor de rezonanță, are o sarcină parțială pozitivă.
Încărcarea pozitivă atrage Nu-, care va căuta să aproximeze printr-un „flanc” astfel încât să existe cel mai puțin obstacol steric din substituenții R și R '. În funcție de cât de voluminoase sunt sau de dimensiunea Nu-, atacul va avea loc în unghiuri diferite ψ; poate fi foarte deschis sau închis.
Odată ce atacul are loc, se va forma un compus intermediar, Nu-CRR'-O-; adică oxigenul este lăsat cu o pereche de electroni pentru a permite adăugarea Nu- grupa carbonil.
Acest oxigen încărcat negativ poate interveni în alte etape ale reacției; protonat ca o grupare hidroxil, OH, sau eliberat ca o moleculă de apă.
Mecanismele implicate, precum și produsele de reacție obținute prin acest atac, sunt foarte variate..
Derivate
Agentul nucleofil Nu- poate fi vorba de multe specii. Pentru fiecare în mod specific, atunci când reacționează cu gruparea carbonil, apar diferiți derivați.
De exemplu, atunci când respectivul agent nucleofil este o amină, NHDouăR, iminele provin, RDouăC = NR; dacă este hidroxilamină, NHDouăOH, dă naștere la oxime, RR'C = NOH; dacă este anionul cianură, CN-, se produc cianohidrine, RR'C (OH) CN și așa mai departe cu alte specii.
Reducere
La început s-a spus că acest grup este oxigenat și, prin urmare, oxidat. Aceasta înseamnă că, având în vedere condițiile, acesta poate fi redus sau poate pierde legături cu atomul de oxigen prin înlocuirea acestuia cu hidrogeni. De exemplu:
C = O => CHDouă
Această transformare indică faptul că gruparea carbonil a fost redusă la o grupare metilen; a fost un câștig de hidrogen ca urmare a pierderii de oxigen. În termeni chimici mai adecvați: compusul carbonilic este redus la un alcan.
Dacă este o cetonă, RCOR ', în prezența hidrazinei, HDouăN-NHDouă, și un mediu puternic bazic poate fi redus la alcanul respectiv; Această reacție este cunoscută sub numele de reducere Wolff-Kishner:
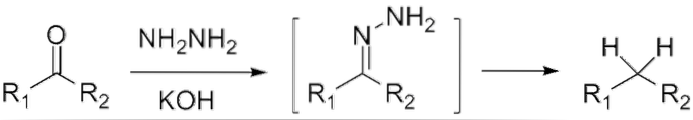
Dacă, pe de altă parte, amestecul de reacție constă din zinc amalgamat și acid clorhidric, reacția este cunoscută sub numele de reducere Clemmensen:
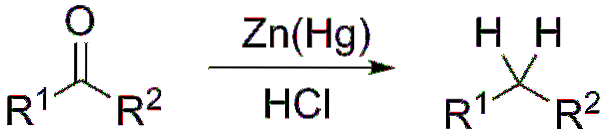
Formarea acetalilor și cetalilor
Gruparea carbonil nu poate adăuga doar agenți nucleofili Nu-, dar în condiții acide poate reacționa și cu alcooli prin mecanisme similare.
Atunci când o aldehidă sau cetonă reacționează parțial cu un alcool, se produc hemiacetale sau, respectiv, hemicetale. Dacă reacția este completă, produsele sunt acetali și cetali. Următoarele ecuații chimice rezumă și clarifică ceea ce tocmai a fost menționat:
RCHO + R3OH g RCHOH (OR3) (Hemiacetal) + R4OH g RCH (OR3) (SAU4) (Acetal)
RCORDouă + R3OH g RCORDouă(OH) (SAU3) (Hemiketal) + R4OH g RCORDouă(SAU3) (SAU4) (ketal)
Prima reacție corespunde formării hemiacetalelor și acetalilor dintr-o aldehidă, iar a doua a hemicetalelor și cetalelor dintr-o cetonă.
Este posibil ca aceste ecuații să nu fie suficient de simple pentru a explica formarea acestor compuși; Cu toate acestea, pentru o primă abordare a subiectului, este suficient să înțelegem că se adaugă alcooli și că lanțurile lor laterale R (R3 și R4) se leagă de carbonil carbonil. De aceea se adaugă SAU3 și SAU4 la molecula inițială.
Principala diferență dintre un acetal și un ketal este prezența atomului de hidrogen legat de carbon. Rețineți că cetonei nu are acest hidrogen.
Tipuri
Foarte similar așa cum s-a explicat în secțiunea de nomenclatură pentru gruparea carbonil, tipurile sale sunt o funcție a cărora sunt substituenții A și B sau R și R '. Prin urmare, există caracteristici structurale care împărtășesc o serie de compuși carbonilici dincolo de ordinul sau tipul de legături..
De exemplu, a fost menționată la începutul analogiei dintre acest grup și monoxidul de carbon, C≡O. Dacă molecula este lipsită de atomi de hidrogen și dacă există și doi terminali C = O, atunci va fi un oxid de carbon, CnSAUDouă. Pentru n egal cu 3, vom avea:
O = C = C = C = O
Ceea ce este ca și cum ar exista două molecule de C≡O unite și separate de un carbon.
Compușii carbonilici pot fi derivați nu numai din gazul CO, ci și din acidul carbonic, HDouăCO3 sau OH- (C = O) -OH. Aici cei doi OH reprezintă R și R 'și înlocuind fie unul dintre ei, fie hidrogenii lor, se obțin derivați ai acidului carbonic.
Și apoi sunt derivații acizilor carboxilici, RCOOH, obținuți prin schimbarea identităților lui R sau prin substituirea lui H cu un alt atom sau lanț R '(care ar da naștere unui ester, RCOOR').
Cum să-l identificăm în aldehide și cetone
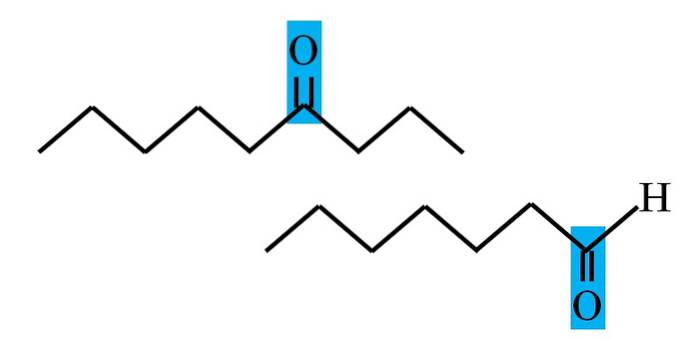
Atât aldehidele, cât și cetonele au în comun prezența grupării carbonil. Proprietățile sale chimice și fizice i se datorează. Cu toate acestea, mediile lor moleculare nu sunt aceleași în ambii compuși; în prima se află într-o poziție terminală, iar în cea din urmă, oriunde în lanț.
De exemplu, în imaginea de mai sus, grupul carbonil se află într-o cutie albastră. În cetone, lângă această cutie trebuie să existe un alt segment de carbon sau lanț (sus); în timp ce în aldehide, nu poate exista decât un singur atom de hidrogen (jos).
Dacă C = O se află la un capăt al lanțului, va fi o aldehidă; acesta este cel mai direct mod de a-l diferenția de o cetonă.
ID
Dar de unde știi experimental dacă un compus necunoscut este o aldehidă sau o cetonă? Există numeroase metode, de la spectroscopice (absorbția radiațiilor infraroșii, IR), sau teste organice calitative.
În ceea ce privește testele calitative, acestea se bazează pe reacții care, atunci când sunt pozitive, analistul va observa un răspuns fizic; o schimbare de culoare, eliberarea de căldură, formarea de bule etc..
De exemplu, atunci când se adaugă o soluție acidă de KDouăCrDouăSAU7 aldehida se va transforma în acid carboxilic, ceea ce face ca culoarea soluției să se schimbe de la portocaliu la verde (test pozitiv). Între timp, cetonele nu reacționează și, prin urmare, analistul nu observă nicio schimbare de culoare (test negativ).
Un alt test constă în utilizarea reactivului Tollens, [Ag (NH3)Două]+, pentru ca aldehida să reducă cationii Ag+ la argint metalic. Și rezultatul: formarea unei oglinzi de argint în partea de jos a eprubetei unde a fost plasată proba..
Exemple principale
În cele din urmă, vor fi enumerate o serie de exemple de compuși carbonilici:
-CH3COOH, acid acetic
-HCOOH, acid formic
-CH3Mașină3, propanonă
-CH3MașinăDouăCH3, 2-butanonă
-C6H5Mașină3, acetofenona
-CH3CHO, etanal
-CH3CHDouăCHDouăCHDouăCHO, pentanal
-C6H5CHO, benzaldehidă
-CH3CONHDouă, acetamidă
-CH3CHDouăCHDouăVĂRĂTOR3, acetat de propil
Acum, dacă sunt citate exemple de compuși care pur și simplu posedă acest grup, lista ar deveni aproape fără sfârșit.
Referințe
- Morrison, R. T. și Boyd, R, N. (1987). Chimie organica. Ediția a V-a. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Chimie organica. (Ediția a șasea). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organica. Amine. (Ediția a X-a.). Wiley plus.
- Reid Danielle. (2019). Grupul Carbonyl: Proprietăți și prezentare generală. Studiu. Recuperat de la: study.com
- Sharleen Agvateesiri. (05 iunie 2019). Grupul Carbonyl. Chimie LibreTexte. Recuperat de pe: chem.libretexts.org
- Wiki Kids Ltd. (2018). Compuși carbonilici. Recuperat din: pur și simplu.știință
- Toppr. (s.f.). Nomenclatura și structura grupului carbonil. Recuperat de pe: toppr.com
- Clark J. (2015). Oxidarea aldehidelor și cetonelor. Recuperat de pe: chemguide.co.uk



Nimeni nu a comentat acest articol încă.