
Structura, proprietățile și utilizările heptanului (C7H16)
heptan este un compus organic a cărui formulă chimică este C7H16 și cuprinde nouă izomeri structurali, dintre care cel mai cunoscut este liniar. Este o hidrocarbură, în special un alcan sau parafină, care se găsește în majoritatea laboratoarelor de chimie organică, indiferent dacă este predare sau cercetare..
Spre deosebire de alți solvenți parafinici, heptanul are o volatilitate mai mică, ceea ce îl face relativ mai sigur de utilizat; cu condiția să nu existe o sursă de căldură în jurul vaporilor dvs. și să lucrați în interiorul unei hote extractoare. Lăsând deoparte inflamabilitatea, este un compus suficient de inert pentru a servi ca mediu pentru reacțiile organice..
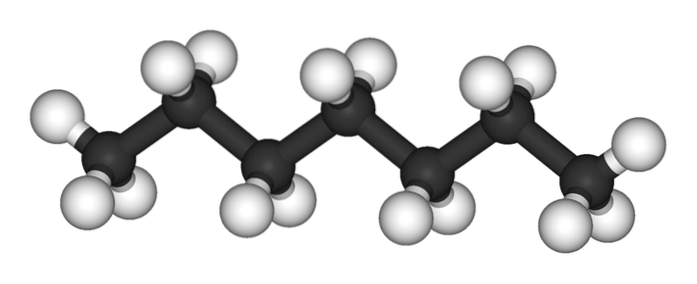
Imaginea superioară arată structura n-heptan, izomerul liniar al tuturor heptanilor. Deoarece este cel mai comun și mai valoros izomer comercial, precum și cel mai ușor de sintetizat, tinde să se înțeleagă că termenul „heptan” se referă exclusiv la n-heptan; dacă nu se specifică altfel.
Cu toate acestea, sticlele acestui compus lichid specifică că acesta conține n-heptan. Acestea trebuie să fie descoperite în interiorul unei hote extractoare și măsurătorile trebuie luate cu atenție.
Este un solvent excelent pentru grăsimi și uleiuri, motiv pentru care este utilizat frecvent în timpul extracțiilor esențelor de plante sau a altor produse naturale..
Indice articol
- 1 Structură
- 1.1 n-heptan și interacțiunile sale intermoleculare
- 1.2 Izomeri
- 2 Proprietățile heptanului
- 2.1 Aspect fizic
- 2.2 Masa molară
- 2.3 Punctul de topire
- 2.4 Punctul de fierbere
- 2.5 Presiunea vaporilor
- 2.6 Densitate
- 2.7 Solubilitatea în apă
- 2.8 Solubilitatea în alți solvenți
- 2.9 Indicele de refracție (nD)
- 2.10 Vâscozitatea
- 2.11 Capacitate termică
- 2.12 Punct de aprindere
- 2.13 Temperatura de autoinflamare
- 2.14 Tensiunea superficială
- 2.15 Căldura de ardere
- 2.16 Reactivitate
- 3 utilizări
- 3.1 Solvent și mediu de reacție
- 3.2 Agent de precipitare
- 3.3 Octan
- 4 Referințe
Structura
n-heptan și interacțiunile sale intermoleculare
După cum se poate vedea în prima imagine, molecula de n-Heptanul este liniar și, datorită hibridizării chimice a atomilor săi de carbon, lanțul își asumă o formă în zigzag. Această moleculă este dinamică, deoarece legăturile sale C-C se pot roti, determinând lanțul să se îndoaie ușor sub diferite unghiuri. Acest lucru contribuie la interacțiunile lor intermoleculare..
n-heptanul este o moleculă apolară, hidrofobă și, prin urmare, interacțiunile sale se bazează pe forțele dispersive londoneze; Acestea sunt cele care depind de masa moleculară a compusului și de aria de contact a acestuia. Două molecule de n-heptanul se apropie unul de altul în așa fel încât să-și „pună” lanțurile unul peste altul.
Aceste interacțiuni sunt suficient de eficiente pentru a păstra moleculele de n-Heptanul coeziv într-un lichid care fierbe la 98 ° C.
Izomeri
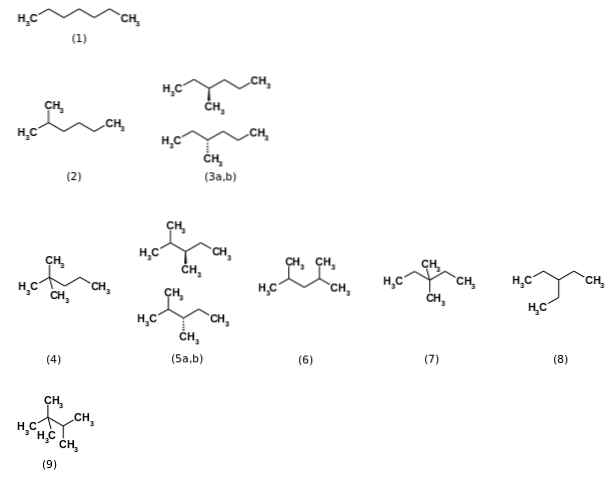
La început s-a spus că formula C7H16 a reprezentat un total de nouă izomeri structurali, fiind n-heptanul cel mai relevant (1). Ceilalți opt izomeri sunt afișați în imaginea de mai sus. Rețineți dintr-o privire că unele sunt mai ramificate decât altele. De la stânga la dreapta, începând de sus, avem:
(2): 2-metilhexan
(3): 3-metilhexan, care constă dintr-o pereche de enantiomeri (a și b)
(4): 2,2-dimetilpentan, cunoscut și sub numele de neoheptan
(5): 2,3-dimetilpentan, din nou cu o pereche de enantiomeri
(6): 2,4-dimetilpentan
(7): 3,3-dimetilpentan
(8): 3-etilpentan
(9): 2,2,3-trimetilbutan.
Fiecare dintre acești izomeri au proprietăți și aplicații independente de n-heptan, rezervat mai ales zonelor de sinteză organică.
Proprietăți heptanice
Aspectul fizic
Lichid incolor cu miros asemănător benzinei.
Masă molară
100,205 g / mol
Punct de topire
-90.549 ºC, devenind un cristal molecular.
Punct de fierbere
98,38 ºC.
Presiunea de vapori
52,60 atm la 20 ° C. Rețineți cât de mare este presiunea sa de vapori, deși este mai puțin volatilă decât alți solvenți parafinici, cum ar fi hexanul și pentanul..
Densitate
0,6795 g / cm3. Pe de altă parte, vaporii de heptan sunt de 3,45 ori mai densi decât aerul, ceea ce înseamnă că vaporii lui vor rămâne în spații în care se scurge puțin din lichidul său..
Solubilitatea apei
Heptanul, fiind un compus hidrofob, abia se poate dizolva în apă pentru a produce o soluție cu o concentrație de 0,0003% la o temperatură de 20 ° C..
Solubilitate în alți solvenți
Heptanul este miscibil cu tetraclorură de carbon, etanol, acetonă, petrol ușor și cloroform..
Indicele de refracție (nD)
1,3855.
Viscozitate
0,389 mPa s
Capacitate de căldură
224,64 J / K mol
punctul de aprindere
-4 ° C
temperatură de autoaprindere
223 ºC
Tensiune de suprafata
19,66 mN / m la 25 ° C
Căldura de ardere
4817 kJ / mol.
Reactivitate
Vaporii de heptan când sunt aproape de o sursă de căldură (o flacără), reacționează exoterm și energic cu oxigenul din aer:
C7H16 + 11ODouă => 7CODouă + 8HDouăSAU
Cu toate acestea, în afara reacției de ardere, heptanul este un lichid destul de stabil. Lipsa sa de reactivitate se datorează faptului că legăturile sale C-H sunt greu de rupt, deci nu este susceptibilă de substituții. La fel, nu este foarte sensibil la agenții oxidanți puternici, atâta timp cât nu există foc în apropiere..
Cel mai mare pericol al heptanului este volatilitatea și inflamabilitatea ridicate, deci există riscul de incendiu dacă este vărsat în locuri fierbinți.
Aplicații
Solvent și mediu de reacție

Caracterul hidrofob al heptanului îl face un solvent excelent pentru dizolvarea uleiurilor și grăsimilor. În acest aspect a fost folosit ca degresant. Cu toate acestea, cea mai mare aplicare a sa constă în utilizarea sa ca solvent de extracție, deoarece dizolvă componentele lipidice, precum și ceilalți compuși organici ai unei probe..
De exemplu, dacă ați dori să extrageți toate componentele cafelei măcinate, aceasta ar fi macerată în heptan în loc de apă. Această metodă și variațiile sale au fost implementate cu toate tipurile de semințe, datorită cărora s-au obținut esențe de plante și alte produse naturale..
Heptanul, care este în mod natural incolor, se va nuanța în culoarea uleiului extras. Apoi, este rotit pentru a avea în cele din urmă un volum de ulei cât mai pur posibil..
Pe de altă parte, reactivitatea scăzută a heptanului îi permite, de asemenea, să fie o opțiune atunci când se ia în considerare un mediu de reacție pentru a efectua o sinteză. Fiind un bun solvent pentru compușii organici, asigură faptul că reactivii rămân în soluție și interacționează corect între ei în timp ce reacționează.
Agent de precipitare
În chimia petrolului, este o practică obișnuită precipitarea asfaltenelor dintr-o probă brută prin adăugarea de heptan. Această metodă permite studierea stabilității diferitelor uleiuri brute și determinarea cât de susceptibilă este conținutul lor de asfalten la precipitarea și provocarea unei serii întregi de probleme pentru industria petrolieră..
Octan
Heptanul a fost folosit ca combustibil din cauza cantității mari de căldură pe care o degajă atunci când arde. Cu toate acestea, în ceea ce privește motoarele auto, ar fi în detrimentul performanței lor dacă ar fi utilizate în formă pură. Deoarece arde foarte exploziv, servește la definirea 0 pe scara octanică benzină..
Benzina conține un procent ridicat de heptan și alte hidrocarburi pentru a aduce numărul octanic la valorile cunoscute (91, 95, 87, 89 etc.).
Referințe
- Morrison, R. T. și Boyd, R, N. (1987). Chimie organica. Ediția a V-a. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Chimie organica. (Ediția a șasea). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organica. (Ediția a X-a.). Wiley plus.
- Wikipedia. (2020). Heptan. Recuperat de pe: en.wikipedia.org
- Centrul Național pentru Informații despre Biotehnologie. (2020). Baza de date Heptane PubChem. CID = 8900. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Elsevier B.V. (2020). Heptani ScienceDirect. Recuperat de pe: sciencedirect.com
- Bell Chem Corp. (7 septembrie 2018). Utilizări industriale ale heptanului. Recuperat de la: bellchem.com
- Andrea Kropp. (2020). Heptan: Structură, utilizări și formulă. Studiu. Recuperat de la: study.com


Nimeni nu a comentat acest articol încă.