
Structuri, funcții, forme ale hexokinazei

hexokinaza (HK) este enzima care catalizează prima reacție a căii glicolitice în practic toate organismele vii, atât procariote, cât și eucariote. Este responsabil pentru transferul unei grupări fosforil în glucoză, producând glucoză-6P, deși poate fosforila și alte zaharuri hexoze (6 atomi de carbon).
Această enzimă este clasificată în una din cele două familii de enzime glucoz kinază (enzime care transferă grupări fosforil pe substraturi precum glucoza): familia hexokinazei (HK), ai cărei membri sunt subdivizați în trei grupuri diferite cunoscute sub numele de grupul HK, grupul A și grupa B..
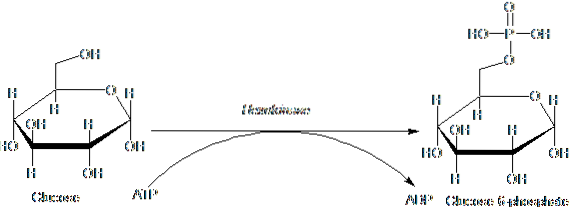
Enzimele aparținând familiei HK se caracterizează prin fosforilarea glucozei în detrimentul ATP ca moleculă donatoare de grup fosforil, iar membrii săi diferă între ei în principal în ceea ce privește greutatea moleculară și specificitatea substratului..
Grupul HK include enzimele organismelor eucariote (ATP: D-hexoză 6-fosfotransferaze), în timp ce grupul A este reprezentat de enzimele bacteriilor gram-negative, cianobacterii, protiști amitocondriați și tripanosomatide, iar grupul B conține enzimele gram-pozitive bacterii și organisme crenoqueotice.
Enzimele din grupele A și B sunt, de asemenea, cunoscute sub numele de glucokinaze (GlcKs), deoarece sunt capabile să fosforileze exclusiv glucoza, motiv pentru care aceste enzime sunt numite ATP: D-glucoză 6-fosfotransferaze.
Ca enzimă glicolitică, hexokinaza are o mare importanță metabolică, deoarece fără aceasta această cale importantă nu ar fi posibilă și celulele foarte dependente de consumul de carbohidrați, cum ar fi creierul și celulele musculare ale multor mamifere, ar avea impedimente funcționale și fiziologice grave.
Indice articol
- 1 Structură
- 2 Funcții
- 2.1 La plante
- 3 forme
- 4 Referințe
Structura
După cum se va vedea mai târziu, există diferite tipuri de enzime hexokinaze la mamifere și alte vertebrate (precum și la organismele unicelulare, cum ar fi drojdia). La mamifere, au fost descrise patru: izoformele I, II, III și IV.
Primele trei izozime au greutate moleculară de 100 kDa, dar izozima IV are 50 kDa. Aceste izoenzime (în special I-III) prezintă o mare similaritate de secvență între ele în ceea ce privește capetele lor C și N, precum și cu alți membri ai familiei hexokinazei..
Domeniul N-terminal al acestor enzime este considerat domeniul „reglator”, în timp ce activitatea catalitică este realizată de domeniul C-terminal (mamiferul HK II are situri active în ambele domenii).
Domeniul N-terminal este legat de domeniul C-terminal printr-o helix alfa, fiecare având aproximativ 50 kDa în greutate moleculară și are un situs de legare pentru glucoză.
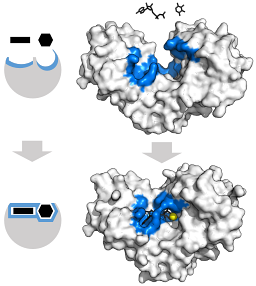
Structura terțiară a acestor enzime este în esență compusă din foi îndoite β amestecate cu helice alfa, a căror proporție variază în raport cu enzima și speciile în cauză; locul de legare pentru ATP, celălalt substrat pentru hexokinază, este de obicei compus din cinci foi β și două elice alfa.
Caracteristici
Hexokinaza are o funcție transcendentală în metabolismul glucidic al majorității ființelor vii, deoarece catalizează primul pas al căii glicolitice, medianând fosforilarea glucozei în interiorul celulei..
Acest prim pas al glicolizei, care constă în transferul unei grupări fosforil de la ATP (donator) la glucoză, producând glucoză 6-fosfat și ADP, este prima dintre cele două etape de investiții energetice sub formă de ATP..
Mai mult, reacția catalizată de hexokinază este etapa de „activare” a glucozei pentru prelucrarea ulterioară și reprezintă o etapă de „angajament”, deoarece glucoza astfel fosforilată nu poate părăsi celula prin intermediul transportorilor săi convenționali din membrană..
Produsul reacției catalizate de hexokinază, adică glucoză 6-fosfat, este un punct ramificat, deoarece este primul substrat utilizat în calea pentozei fosfat și în sinteza glicogenului la multe animale (și amidonul din plante).
În plante
Funcția hexokinazei la plante nu este foarte diferită de cea a animalelor sau microorganismelor, cu toate acestea, la plantele superioare această enzimă funcționează și ca „senzor” al concentrației de zaharuri..
Importanța acestei funcții în aceste organisme are legătură cu participarea zaharurilor ca factori de reglementare în exprimarea genelor care sunt implicate în diferite procese metabolice, cum ar fi:
- Fotosinteză
- Ciclul glioxilat
- Respirația
- Degradarea sau sinteza amidonului și zaharozei
- Metabolismul azotului
- Apărare împotriva agenților patogeni
- Reglarea ciclului celular
- Răspunsul vindecător
- Pigmentare
- Senescența, printre altele.
Această funcție a hexokinazei ca „senzor” a cantității de glucoză intracelulară a fost descrisă și pentru drojdie și mamifere..
Forme
În natură există diferite forme de hexokinaze și acest lucru depinde în mod fundamental de specia considerată.
La om și alte animale vertebrate, de exemplu, a fost demonstrată existența a 4 izoforme diferite ale enzimei hexokinazei în compartimentul citosolic, care au fost denotate cu numerele romane I, II, III și IV.
Izoenzimele I, II și III au o greutate moleculară de 100 kDa, sunt inhibate de produsul lor de reacție (glucoză 6-fosfat) și sunt foarte legate de glucoză, adică au o constantă de Km foarte mică. Cu toate acestea, aceste enzime au o specificitate slabă a substratului, fiind capabile să fosforileze alte hexoze, cum ar fi fructoza și manoza..
Isoenzima IV, cunoscută și sub denumirea de glucokinază (GlcK), are doar 50 kDa în greutate moleculară și, în ciuda faptului că este slab legată (valori mari ale Km), are o specificitate ridicată pentru glucoză ca substrat și nu este supusă acestora. celelalte trei izoenzime.
Glucokinaza (izoenzima IV a hexokinazei multor mamifere) se găsește în principal în ficat și ajută acest organ la „ajustarea” ratei consumului de glucoză ca răspuns la variațiile acestui substrat din sângele circulant..
Cele trei gene care codifică hexokinazele I, II și III la animale par să aibă același strămoș de 50 kDa care a fost duplicat și contopit în genom, ceea ce pare evident atunci când se observă că activitatea catalitică a formelor I și III rezidă doar la capătul C-terminal.
Referințe
- Aronoff, S. L., Berkowitz, K., Shreiner, B. și Want, L. (2004). Metabolizarea și reglarea glucozei: dincolo de insulină și glucagon. Spectrul diabetului, 17(3), 183-190.
- Harrington, G. N. și Bush, D. R. (2003). Rolul bifuncțional al hexokinazei în metabolism și în semnalizarea glucozei. Celula vegetală, cincisprezece(11), 2493-2496.
- Jang, J. C., León, P., Zhou, L. și Sheen, J. (1997). Hexokinaza ca senzor de zahăr la plantele superioare. Celula vegetală, 9(1), 5-19.
- Kawai, S., Mukai, T., Mori, S., Mikami, B. și Murata, K. (2005). Ipoteza: structuri, evoluție și strămoșul glucozei kinaze din familia hexokinazelor. Journal of Bioscience and Bioengineering, 99(4), 320-330.
- Mathews, K. E. (1998). Van Holde. Biochimie.
- Wilson, J. E. (2003). Izozime ale hexokinazei mamiferelor: structură, localizare subcelulară și funcție metabolică. Journal of Experimental Biology, 206(12), 2049-2057.



Nimeni nu a comentat acest articol încă.