
Istoria, structura, proprietățile și utilizările hidrogenului
hidrogen Este un element chimic care este reprezentat de simbolul H. Atomul său este cel mai mic dintre toți și este cu care începe tabelul periodic, indiferent unde este poziționat. Se compune dintr-un gaz incolor compus din molecule H diatomiceDouă, și nu prin atomi de H izolați; așa cum se întâmplă cu gazele nobile He, Ne, Ar, printre altele.
Dintre toate elementele, este probabil cel mai emblematic și remarcabil, nu numai pentru proprietățile sale în condiții terestre sau drastice, ci și pentru imensa abundență și varietatea compușilor săi. Hidrogenul este un gaz, deși inert în absența focului, inflamabil și periculos; în timp ce apă, HDouăOr, este solventul universal și viața.

În sine, hidrogenul nu prezintă nicio particularitate vizuală demnă de admirație, fiind pur și simplu un gaz care este stocat în butelii sau sticle roșii. Cu toate acestea, proprietățile și capacitatea sa de a se lega de toate elementele, fac ca hidrogenul să fie special. Și toate acestea, în ciuda faptului că are doar un electron de valență.
Dacă hidrogenul nu ar fi depozitat în cilindrii respectivi, ar scăpa în spațiu în timp ce o mare parte din acesta reacționează la urcare. Și, deși are o concentrație foarte scăzută în aerul pe care îl respirăm, în afara Pământului și în restul Universului, este cel mai abundent element, găsit în stele și considerat unitatea sa de construcție..
Pe Pământ, pe de altă parte, reprezintă aproximativ 10% din masa sa totală. Pentru a vizualiza ce înseamnă acest lucru, trebuie considerat că suprafața planetei este practic acoperită cu oceane și că hidrogenul se găsește în minerale, în țiței și în orice compus organic, pe lângă faptul că face parte din toate ființele vii..
La fel ca și carbonul, toate biomoleculele (carbohidrați, proteine, enzime, ADN etc.) au atomi de hidrogen. Prin urmare, există multe surse de extragere sau producere; cu toate acestea, puțini reprezintă metode de producție cu adevărat profitabile.
Indice articol
- 1 Istorie
- 1.1 Identificare și nume
- 1.2 Electroliză și combustibil
- 1.3 Izolarea
- 1.4 Două canale
- 2 Structură și configurație electronică
- 2.1 numere de oxidare
- 2.2 Faze
- 3 Proprietăți
- 3.1 Aspect fizic
- 3.2 Punctul de fierbere
- 3.3 Punctul de topire
- 3.4 Punct de aprindere și stabilitate
- 3.5 Densitate
- 3.6 Solubilitate
- 3.7 Presiunea vaporilor
- 3.8 Temperatura de autoinflamare
- 3.9 Electronegativitate
- 3.10 Căldura de ardere
- 3.11 Căldura de vaporizare
- 3.12 Căldura de fuziune
- 3.13 Izotopi
- 3.14 Izomeri de rotiri
- 4 Nomenclatură
- 5 Atomul de hidrogen
- 6 Unde se găsește și se produce
- 6.1 Natural
- 6.2 Industrial
- 6.3 În laborator
- 7 Reacții
- 7.1 Redox
- 7.2 Absorbție
- 7.3 Adăugare
- 7.4 Formarea hidrurii
- 8 utilizări
- 8.1 Materie primă
- 8.2 Agent de reducere
- 8.3 Industria petrolieră
- 8.4 Combustibil
- 9 Referințe
Poveste
Identificare și nume
Deși în 1671 Robert Boyle a asistat pentru prima dată la un gaz care s-a format atunci când piliturile de fier au reacționat cu acizi, omul de știință britanic Henry Cavendish, în 1766, a identificat-o ca o substanță nouă; „aerul inflamabil”.
Cavendish a descoperit că, atunci când acest aer presupus inflamabil a ars, a fost generată apă. Pe baza lucrărilor și rezultatelor sale, chimistul francez Antoine Lavoisier a dat acestui gaz numele de hidrogen în 1783. Etimologic semnificația acestuia derivă din cuvintele grecești „hidro” și „gene”: formarea apei.
Electroliză și combustibil
La scurt timp, în 1800, oamenii de știință americani William Nicholson și Sir Anthony Carlisle au descoperit că apa se poate descompune în hidrogen și oxigen; găsiseră electroliza apei. Mai târziu, în 1838, chimistul elvețian Christian Friedrich Schoenbein a introdus ideea de a profita de arderea hidrogenului pentru a genera electricitate.
Popularitatea hidrogenului a fost atât de mare încât chiar și scriitorul Jules Verne s-a referit la acesta ca fiind combustibilul viitorului în cartea sa Insula misterioasă (1874).
Izolare
În 1899, chimistul scoțian James Dewar a fost primul care a izolat hidrogenul ca gaz lichefiat, fiind el însuși cel care a putut să-l răcească suficient pentru a-l obține în faza sa solidă..
Două canale
Din acest moment, istoria hidrogenului prezintă două canale. Pe de o parte, dezvoltarea sa în domeniul combustibililor și bateriilor; iar pe de altă parte, înțelegerea structurii atomului său și modul în care acesta a reprezentat elementul care a deschis ușile fizicii cuantice.
Structura și configurația electronică

Atomii de hidrogen sunt foarte mici și au un singur electron pentru a forma legături covalente. Când doi dintre acești atomi se unesc, dau naștere unei molecule diatomice, HDouă; acesta este hidrogen gazos molecular (imaginea de sus). Fiecare sferă albă corespunde unui atom individual de H, iar sfera globală orbitalilor moleculari.
Deci, hidrogenul constă de fapt din molecule de HDouă foarte mici, care interacționează prin intermediul forțelor de dispersie din Londra, deoarece le lipsește un moment dipol, deoarece sunt homonucleare. Prin urmare, sunt foarte „neliniștiți” și se răspândesc rapid în spațiu, deoarece nu există forțe intermoleculare suficient de puternice pentru a le încetini..
Configurația electronică a hidrogenului este pur și simplu 1s1. Acest orbital, 1s, este produsul rezolvării celebrei ecuații Schrödinger pentru atomul de hidrogen. În HDouă doi orbitali 1s se suprapun pentru a forma doi orbitali moleculari: unul de legătură și unul de anti-legătură, conform teoriei orbitale moleculare (TOM).
Acești orbitali permit sau explică existența ionilor HDouă+ sau HDouă-; cu toate acestea, chimia hidrogenului este definită în condiții normale de HDouă sau ionii H+ sau H-.
Numere de oxidare
Din configurația electronică pentru hidrogen, 1s1, numerele sale posibile de oxidare sunt foarte ușor de prezis; ținând cont, desigur, că orbitalul cu energie superioară 2s nu este disponibil pentru legături chimice. Astfel, în stare bazală, hidrogenul are un număr de oxidare de 0, H0.
Dacă își pierde singurul electron, orbitalul 1s rămâne gol și se formează ionul de hidrogen sau cationul, H.+, foarte mobil în aproape orice mediu lichid; mai ales apa. În acest caz numărul său de oxidare este +1.
Și când se întâmplă opusul, adică câștigarea unui electron, orbitalul va avea acum doi electroni și va deveni 1sDouă. Apoi, numărul de oxidare devine -1 și corespunde anionului hidrură, H-. Este demn de remarcat faptul că H- este izoelectronic pentru gazul nobil heliu, He; adică ambele specii au același număr de electroni.
Pe scurt, numerele de oxidare pentru hidrogen sunt: +1, 0 și -1 și molecula HDouă contează ca având doi atomi de hidrogen H0.
Etape
Faza preferată a hidrogenului, cel puțin în condiții terestre, este cea gazoasă, din motivele expuse anterior. Cu toate acestea, atunci când temperaturile scad în ordinea de -200 ° C, sau dacă presiunea crește de sute de mii de ori mai mare decât cea atmosferică, hidrogenul se poate condensa sau cristaliza într-o fază lichidă sau respectiv solidă..
În aceste condiții moleculele HDouă pot fi aliniate în diferite moduri pentru a defini tiparele structurale. Forțele de dispersie de la Londra devin acum foarte direcționale și, prin urmare, apar geometrii sau simetrii adoptate de perechile H.Două.
De exemplu, două perechi HDouă, este egal cu a scrie (HDouă)Două definiți un pătrat simetric sau asimetric. Între timp, trei perechi HDouă, sau (HDouă)3 definește un hexagon, la fel ca cele ale carbonului din cristalele de grafit. De fapt, această fază hexagonală este faza principală sau cea mai stabilă pentru hidrogenul solid..
Dar dacă solidul nu ar fi format din molecule, ci din atomi de H? Apoi ne-am ocupa de hidrogenul metalic. Acești atomi de H, amintind de sferele albe, pot defini atât o fază lichidă, cât și un solid metalic..
Proprietăți
Aspectul fizic
Hidrogenul este un gaz incolor, inodor și fără gust. Prin urmare, dacă există o scurgere, aceasta reprezintă un risc de explozie..
Punct de fierbere
-253 ºC.
Punct de topire
-259 ºC.
Punct de aprindere și stabilitate
Explodează practic la orice temperatură dacă există o scânteie sau o sursă de căldură aproape de gaz, chiar și lumina soarelui poate aprinde hidrogen. Cu toate acestea, atâta timp cât este bine depozitat, este un gaz slab reactiv..
Densitate
0,082 g / L. Este de 14 ori mai ușoară decât aerul.
Solubilitate
1,62 mg / L la 21 ° C în apă. Este, în termeni generali, insolubil în majoritatea lichidelor.
Presiunea de vapori
1.24 106 mmHg la 25 ° C. Această valoare oferă o idee despre cât de închise trebuie să fie buteliile de hidrogen pentru a preveni scurgerea gazului.
temperatură de autoaprindere
560vºC.
Electronegativitate
2.20 pe scara Pauling.
Căldura de ardere
-285,8 kJ / mol.
Căldura de vaporizare
0,90 kJ / mol.
Căldura de fuziune
0,117 kJ / mol.
Izotopi
Atomul de hidrogen „normal” este protiul, 1H, care reprezintă aproximativ 99,985% hidrogen. Ceilalți doi izotopi pentru acest element sunt deuteriu, DouăH și tritiu, 3H. Acestea diferă prin numărul de neutroni; deuteriul are un neutron, în timp ce tritiul are doi.
Izomeri de centrifugare
Există două tipuri de hidrogen molecular, HDouă: orto și para. În prima, cele două rotiri (ale protonului) atomilor H sunt orientate în aceeași direcție (sunt paralele); în timp ce în a doua, cele două rotiri sunt în direcții opuse (sunt antiparalele).
Hidrogen-para este cel mai stabil dintre cei doi izomeri; dar odată cu creșterea temperaturii, raportul orto: para devine 3: 1, ceea ce înseamnă că izomerul orto-hidrogen predomină asupra celuilalt. La temperaturi foarte scăzute (de la distanță aproape de zero absolut, 20K), pot fi obținute probe de hidrogen pur - pentru.
Nomenclatură
Nomenclatura pentru a se referi la hidrogen este una dintre cele mai simple; deși nu este același mod pentru compușii săi anorganici sau organici. HDouă Poate fi numit prin următoarele nume pe lângă „hidrogen”:
-Hidrogen molecular
-Dihidrogen
-Molecula de hidrogen diatomic.
Pentru ionul H+ numele lor sunt protoni sau ion hidrogen; iar dacă este într-un mediu apos, H3SAU+, cationi de hidroniu. În timp ce ionul H- este anionul hidrură.
Atomul de hidrogen
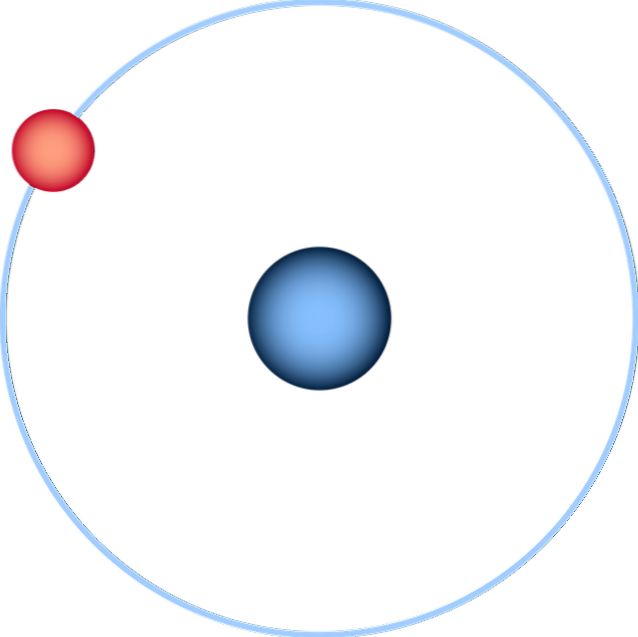
Atomul de hidrogen este cel mai simplu dintre toți și este reprezentat în mod normal ca în imaginea de mai sus: un nucleu cu un singur proton (pentru 1H), înconjurat de un electron care desenează o orbită. Toate orbitalele atomice pentru celelalte elemente ale tabelului periodic au fost construite și estimate pe acest atom..
O reprezentare mai fidelă pentru înțelegerea actuală a atomilor ar fi aceea a unei sfere a cărei periferie este definită de electronul și norul probabilistic al electronului (orbitalul său 1s).
Unde este localizat și producție

Hidrogenul este, deși poate într-o măsură mai mică în comparație cu carbonul, elementul chimic despre care se poate spune fără îndoială că este peste tot; în aer, formând parte din apa care umple mările, oceanele și corpurile noastre, în țiței și minerale, precum și în compușii organici care sunt asamblați pentru a provoca viața.
Este suficient să degajați orice bibliotecă de compuși pentru a găsi atomi de hidrogen în ei..
Întrebarea nu este atât cât de mult, ci cum este prezentă. De exemplu, molecula HDouă este atât de volatil și de reactiv sub incidența razelor solare, încât este foarte rar în atmosferă; de aceea, reacționează pentru a uni alte elemente și astfel a câștiga stabilitate.
În timp ce este mai sus în cosmos, hidrogenul se găsește predominant ca atomi neutri, H.
De fapt, hidrogenul este considerat, în faza sa metalică și condensată, ca elementul constitutiv al stelelor. Deoarece există cantități incomensurabile și, datorită robusteții și dimensiunilor colosale, fac din acest element cel mai abundent din întregul univers. Se estimează că 75% din materia cunoscută corespunde atomilor de hidrogen.
natural
Colectarea atomilor de hidrogen în spațiu sună impracticabil și extragerea lor din periferiile sau nebuloasele Soarelui, inaccesibilă. Pe Pământ, unde condițiile sale forțează acest element să existe ca HDouă, pot fi produse prin procese naturale sau geologice.
De exemplu, hidrogenul are propriul ciclu natural în care anumite bacterii, microbi și alge îl pot genera prin reacții fotochimice. Scalarea proceselor naturale și paralelă cu acestea include utilizarea bioreactoarelor, unde bacteriile se hrănesc cu hidrocarburi pentru a elibera hidrogenul conținut în acestea.
Ființele vii sunt, de asemenea, producători de hidrogen, dar într-o măsură mai mică. Dacă nu ar fi cazul, nu ar fi posibil să se explice modul în care acesta constituie una dintre componentele gazoase ale flatulenței; care s-au dovedit excesiv a fi inflamabile.
În cele din urmă, trebuie menționat faptul că, în condiții anaerobe (fără oxigen), de exemplu în straturile subterane, mineralele pot reacționa lent cu apa pentru a produce hidrogen. Reacția lui Fayelita o dovedește:
3FeDouăda4 + 2 oreDouăO → 2 Fe3SAU4 + 3 SiODouă + 3 HDouă
Industrial
Deși biohidrogenul este o alternativă pentru a genera acest gaz la scară industrială, cele mai utilizate metode constau practic în „îndepărtarea” hidrogenului din compușii care îl conțin, astfel încât atomii săi să se unească și să formeze HDouă.
Cele mai puțin ecologice metode de producere a acestuia constau în reacția cocsului (sau cărbunelui) cu abur supraîncălzit:
C (s) + HDouăO (g) → CO (g) + HDouă(g)
De asemenea, gazul natural a fost utilizat în acest scop:
CH4(g) + HDouăO (g) → CO (g) + 3HDouă(g)
Și pentru că cantitățile de cocs sau gaze naturale sunt vaste, este profitabil să se producă hidrogen prin oricare dintre aceste două reacții..
O altă metodă de obținere a hidrogenului este aplicarea unei descărcări electrice pe apă pentru a o descompune în părțile sale elementare (electroliză):
2 oreDouăO (l) → 2 HDouă(g) + ODouă(g)
La laborator
Hidrogenul molecular poate fi preparat în cantități mici în orice laborator. Pentru a face acest lucru, un metal activ trebuie să reacționeze cu un acid puternic, fie într-un pahar, fie într-o eprubetă. Bulbul observabil este un semn clar de formare a hidrogenului, reprezentat de următoarea ecuație generală:
M (s) + nH+(ac) → Mn+(ac) + HDouă(g)
Unde n este valența metalului. De exemplu, magneziul reacționează cu H+ a produce HDouă:
Mg (s) + 2H+(ac) → MgDouă+(ac) + HDouă(g)
Reacții
Redox
Numerele de oxidare oferă singure o primă privire asupra modului în care hidrogenul participă la reacțiile chimice. HDouă atunci când reacționează, poate rămâne neschimbat sau se poate împărți în ionii H.+ sau H- în funcție de ce specie este legată; dacă sunt mai mult sau mai puțin electronegative decât el.
HDouă nu este foarte reactiv datorită rezistenței legăturii sale covalente, H-H; Totuși, acesta nu este un impediment absolut pentru a reacționa și a forma compuși cu aproape toate elementele din tabelul periodic..
Cea mai cunoscută reacție a sa este cu cea a oxigenului gazos pentru a produce vapori de apă:
HDouă(g) + ODouă(g) → 2HDouăO (g)
Și astfel este afinitatea sa pentru oxigen de a forma molecula de apă stabilă, încât poate chiar reacționa cu el ca un anion O.Două- în anumiți oxizi metalici:
HDouă(g) + CuO (s) → Cu (s) + HDouăO (l)
De asemenea, oxidul de argint reacționează sau este „redus” prin aceeași reacție:
HDouă(g) + AgO (s) → Ag (s) + HDouăO (l)
Aceste reacții de hidrogen corespund tipului redox. Adică reducere-oxidare. Hidrogenul se oxidează atât în prezența oxigenului, cât și a oxizilor metalici ai metalelor mai puțin reactivi decât acesta; de exemplu, cupru, argint, tungsten, mercur și aur.
Absorbţie
Unele metale pot absorbi hidrogen gazos pentru a forma hidruri metalice, care sunt considerate a fi aliaje. De exemplu, metalele de tranziție precum paladiu absorb cantități semnificative de HDouă, fiind asemănătoare cu bureții metalici.
La fel se întâmplă și cu aliajele metalice mai complexe. În acest fel, hidrogenul poate fi stocat prin alte mijloace decât cilindrii săi..
Plus
De asemenea, moleculele organice pot „absorbi” hidrogenul prin diferite mecanisme moleculare și / sau interacțiuni..
Pentru metale, moleculele HDouă sunt înconjurați de atomii metalici din cristalele lor; în timp ce în moleculele organice, legătura H-H se rupe pentru a forma alte legături covalente. Într-un sens mai formalizat: hidrogenul nu este absorbit, ci este adăugat la structură.
Exemplul clasic este adăugarea HDouă la legătura dublă sau triplă a alchenelor sau respectiv a alchinelor, respectiv:
C = C + HDouă → H-C-C-H
C≡C + HDouă → HC = CH
Aceste reacții se mai numesc hidrogenare..
Formarea hidrurii
Hidrogenul reacționează direct cu elementele pentru a forma o familie de compuși chimici numiți hidruri. Există în principal două tipuri: salină și moleculară.
La fel, există hidrurile metalice, care constau din aliajele metalice menționate deja atunci când aceste metale absorb hidrogen gazos; iar cele polimerice, cu rețele sau lanțuri de legături E-H, unde E denotă elementul chimic.
Salină
În hidrurile saline, hidrogenul participă la legarea ionică ca anion hidrură, H-. Pentru ca acest lucru să se formeze, elementul trebuie să fie neapărat mai puțin electronegativ; altfel nu ar renunța la electronii săi la hidrogen.
Prin urmare, hidrurile saline se formează numai atunci când hidrogenul reacționează cu metale extrem de electropozitive, cum ar fi alcalin și alcalin pământos..
De exemplu, hidrogenul reacționează cu sodiu metalic pentru a produce hidrură de sodiu:
2Na (s) + HDouă(g) → 2NaH (s)
Sau cu bariu pentru a produce hidrură de bariu:
Ba (s) + HDouă(g) → BaHDouă(s)
Molecular
Hidrurile moleculare sunt chiar mai cunoscute decât cele ionice. Se mai numesc halogenuri de hidrogen, HX, când hidrogenul reacționează cu un halogen:
ClDouă(g) + HDouă(g) → 2HCl (g)
Aici hidrogenul participă la legătura covalentă ca H+; întrucât diferențele dintre electronegativitățile dintre ambii atomi nu sunt foarte mari.
Aceeași apă poate fi considerată ca o hidrură de oxigen (sau oxid de hidrogen), a cărei reacție de formare a fost deja discutată. Foarte similară este reacția cu sulf pentru a da hidrogen sulfurat, un gaz cu miros urât:
S (s) + HDouă(g) → HDouăS (g)
Dar dintre toate hidrurile moleculare, cel mai faimos (și poate cel mai greu de sintetizat) este amoniacul:
NDouă(g) + 3HDouă(g) → 2NH3(g)
Aplicații
În secțiunea anterioară, una dintre principalele utilizări ale hidrogenului a fost deja abordată: ca materie primă pentru dezvoltarea sintezei, anorganice sau organice. Controlul acestui gaz nu are de obicei alt scop decât acela de a-l face să reacționeze pentru a crea alți compuși decât cei din care a fost extras..
Materii prime
- Este unul dintre reactivii pentru sinteza amoniacului, care la rândul său are aplicații industriale nesfârșite, începând cu producerea de îngrășăminte, chiar și ca material pentru azotarea medicamentelor..
- Se intenționează să reacționeze cu monoxid de carbon și astfel să producă masiv metanol, un reactiv care este extrem de important în biocombustibili..
Agent de reducere
- Este un agent reducător pentru anumiți oxizi metalici, deci este utilizat în reducerea metalurgică (explicat deja în cazul cuprului și al altor metale).
- Reduceți grăsimile sau uleiurile pentru a produce margarină.
Industria petrolieră
În industria petrolieră, hidrogenul este utilizat pentru „hidrotratarea” țițeiului în procesele de rafinare..
De exemplu, încearcă să fragmenteze moleculele mari și grele în molecule mici, cu o cerere mai mare pe piață (hidrocracare); eliberează metalele prinse în cuștile petroporfirinei (hidrodemetalizare); îndepărtați atomii de sulf precum HDouăS (hidrodesulfurare); sau reduceți legăturile duble pentru a crea amestecuri bogate în parafină.
Combustibil
Hidrogenul în sine este un combustibil excelent pentru rachete sau nave spațiale, deoarece cantități mici din acesta, atunci când reacționează cu oxigenul, eliberează cantități imense de căldură sau energie.
La o scară mai mică, această reacție este utilizată pentru proiectarea celulelor de hidrogen sau a bateriilor. Cu toate acestea, aceste celule se confruntă cu dificultăți de a nu putea stoca în mod corespunzător acest gaz; și provocarea de a deveni complet independenți de arderea combustibililor fosili.
În ceea ce privește aspectul pozitiv, hidrogenul folosit ca combustibil eliberează doar apă; în loc de gaze care reprezintă mijloace de poluare pentru atmosferă și ecosisteme.
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Hanyu Liu, Li Zhu, Wenwen Cui și Yanming Ma. (S.f.). Structuri la temperatura camerei de hidrogen solid la presiuni ridicate. Laboratorul de chei de stat al materialelor Superhard, Universitatea Jilin, Changchun 130012, China.
- Pierre-Marie Robitaille. (2011). Hidrogenul metalic lichid: un element constitutiv pentru soarele lichid. Departamentul de Radiologie, Universitatea de Stat din Ohio, 395 W. 12th Ave, Columbus, Ohio 43210, SUA.
- Grupul Bodner. (s.f.). Chimia hidrogenului. Recuperat de la: chemed.chem.purdue.edu
- Wikipedia. (2019). Hidrogen. Recuperat de pe: en.wikipedia.org
- Hydrogen Europe. (2017). Aplicații de hidrogen. Recuperat de pe: hydrogeneurope.eu
- Foist Laura. (2019). Hidrogen: proprietăți și apariție. Studiu. Recuperat de la: study.com
- Jonas James. (4 ianuarie 2009). Istoria hidrogenului. Recuperat de pe: altenergymag.com



Nimeni nu a comentat acest articol încă.