
Structura, proprietățile și utilizările hidroxidului de amoniu
hidroxid de amoniu este un compus cu formula moleculară NH4Oh, oh5NO produs prin dizolvarea gazului amoniacal (NH3) in apa. Din acest motiv, se numește apă de amoniac sau amoniac lichid..
Este un lichid incolor cu un miros foarte intens și ascuțit, care nu este izolabil. Aceste caracteristici au o relație directă cu concentrația de NH3 dizolvat în apă; concentrare care, de fapt, fiind un gaz, poate cuprinde cantități uriașe din acesta dizolvate într-un volum mic de apă.
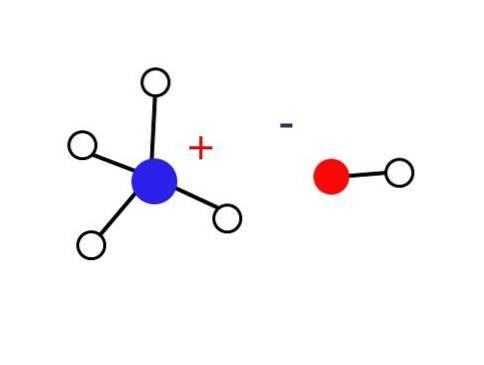
O parte considerabil mică a acestor soluții apoase este compusă din cationi NH.4+ și anionii OH-. Pe de altă parte, în soluții foarte diluate sau în solide înghețate la temperaturi foarte scăzute, amoniacul poate fi găsit sub formă de hidrați, cum ar fi: NH3∙ HDouăSau, 2NH3∙ HDouăO și NH3∙ 2HDouăSAU.
Ca fapt curios, norii lui Jupiter sunt compuși din soluții diluate de hidroxid de amoniu. Cu toate acestea, sonda spațială Galileo nu a reușit să găsească apă în norii planetei, ceea ce ar fi de așteptat datorită cunoștințelor pe care le avem despre formarea hidroxidului de amoniu; adică sunt cristale NH4OH total anhidru.
Ionul de amoniu (NH4+) este produsă în lumenul tubular renal prin uniunea amoniacului și hidrogenului, secretată de celulele tubulare renale. În mod similar, amoniacul este produs în celulele tubulare renale în procesul de transformare a glutaminei în glutamat și, la rândul său, în conversia glutamatului în α-cetoglutarat.
Amoniacul este produs industrial prin metoda Haber-Bosch, în care reacționează gazele de azot și hidrogen; folosind ionul feric, oxidul de aluminiu și oxidul de potasiu ca catalizatori. Reacția se efectuează la presiuni ridicate (150 - 300 atmosfere) și temperaturi ridicate (400 -500 ° C), cu un randament de 10 -20%.
Amoniacul este produs în reacție, care atunci când se oxidează produce nitriți și nitrați. Acestea sunt esențiale în obținerea acidului azotic și a îngrășămintelor precum azotatul de amoniu..
Indice articol
- 1 Structura chimică
- 1.1 Gheață de amoniac
- 2 Proprietăți fizice și chimice
- 2.1 Formula moleculară
- 2.2 Greutate moleculară
- 2.3 Aspect
- 2.4 Concentrație
- 2.5 Miros
- 2.6 Aromă
- 2.7 Valoarea pragului
- 2.8 Punctul de fierbere
- 2.9 Solubilitate
- 2.10 Solubilitate în apă
- 2.11 Densitatea
- 2.12 Densitatea vaporilor
- 2.13 Presiunea vaporilor
- 2.14 Acțiune corozivă
- 2,15 pH
- 2.16 Constanta de disociere
- 3 Nomenclatură
- 4 Solubilitate
- 5 Riscuri
- 5.1 Reactivitate
- 6 utilizări
- 6.1 În alimente
- 6.2 Terapie
- 6.3 Industriale și diverse
- 6.4 În agricultură
- 7 Referințe
Structura chimică
După cum indică definiția sa, hidroxidul de amoniu constă dintr-o soluție apoasă de amoniac gazos. Prin urmare, în interiorul lichidului, nu există o altă structură definită decât cea a unui aranjament aleatoriu de ioni NH.4+ și OH- solvatat de moleculele de apă.
Ionii de amoniu și hidroxil sunt produse ale unui echilibru de hidroliză a amoniacului, deci este obișnuit ca aceste soluții să aibă un miros înțepător:
NH3(g) + HDouăO (l) <=> NH4+(ac) + OH-(ac)
Conform ecuației chimice, o scădere mare a concentrației de apă ar muta echilibrul la formarea mai multor amoniac; adică, pe măsură ce hidroxidul de amoniu este încălzit, vaporii de amoniac vor fi eliberați.
Din acest motiv, ionii NH4+ și OH- nu reușesc să formeze un cristal în condiții terestre, ceea ce duce la baza solidă NH4Oh, nu există.
Respectivul solid ar trebui să fie compus numai din ioni care interacționează electrostatic (așa cum se arată în imagine).
Gheață de amoniac
Cu toate acestea, la temperaturi mult sub 0 ° C și înconjurat de presiuni enorme, cum ar fi cele predominante în nucleele lunilor înghețate, amoniacul și înghețarea apei. Procedând astfel, acestea cristalizează într-un amestec solid cu diferite rapoarte stoichiometrice, cel mai simplu fiind NH3∙ HDouăO: amoniac monohidrat.
NH3∙ HDouăO și NH3∙ 2HDouăSau sunt gheață de amoniac, deoarece solidul constă dintr-un aranjament cristalin de molecule de apă și amoniac legate de legături de hidrogen..
Având în vedere o schimbare în T și P, conform studiilor de calcul care simulează toate variabilele fizice și efectele acestora asupra acestor înghețuri, are loc o tranziție a unei faze NH.3∙ nHDouăSau la o fază NH4Oh.
Prin urmare, numai în aceste condiții extreme NH4OH poate exista ca produs al unei protonații în gheață între NH3 iar HDouăSAU:
NH3(s) + HDouăTu) <=> NH4Oh s)
Rețineți că de această dată, spre deosebire de hidroliza amoniacului, speciile implicate se află într-o fază solidă. O gheață de amoniac care devine sărată fără eliberarea de amoniac.
Proprietati fizice si chimice
Formulă moleculară
NH4Oh, oh5NU
Greutate moleculară
35,046 g / mol
Aspect
Este un lichid incolor.
Concentraţie
Până la aproximativ 30% (pentru ioni NH4+ și OH-).
Miros
Foarte puternic și ascuțit.
Gust
Acru.
Valoarea pragului
34 ppm pentru detectarea nespecifică.
Punct de fierbere
38 ºC (25%).
Solubilitate
Există doar în soluție apoasă.
Solubilitatea apei
Miscibil în proporții nelimitate.
Densitate
0,90 g / cm3 la 25 ° C.
Densitatea vaporilor
În raport cu aerul luat ca unitate: 0,6. Adică este mai puțin dens decât aerul. Cu toate acestea, în mod logic valoarea raportată se referă la amoniac ca gaz, nu la soluțiile sale apoase sau NH4Oh.
Presiunea de vapori
2.160 mmHg la 25 ° C.
Acțiune corozivă
Este capabil să dizolve zincul și cuprul.
pH
11,6 (soluție 1N); 11.1 (soluție 0.1 N) și 10,6 (soluție 0,01 N).
Constanta de disociere
pKb = 4.767; Kb = 1,71 x 10-5 la 20 ° C
pKb = 4.751; Kb = 1.774 x 10-5 la 25ºC.
Creșterea temperaturii crește aproape imperceptibil bazicitatea hidroxidului de amoniu.
Nomenclatură
Care sunt toate numele comune și oficiale pe care le primește NH?4OH? Conform celor stabilite de IUPAC, numele său este hidroxid de amoniu, deoarece conține anionul hidroxil.
Amoniul, datorită încărcării sale +1, este monovalent, așa că folosind nomenclatura Stock este denumit: hidroxid de amoniu (I).
Deși utilizarea termenului de hidroxid de amoniu este incorectă din punct de vedere tehnic, deoarece compusul nu este izolabil (cel puțin nu pe Pământ, așa cum este explicat în detaliu în prima secțiune).
De asemenea, hidroxidul de amoniu se numește apă de amoniac și amoniac lichid..
Solubilitate
NH4OH nu există ca sare în condiții terestre, nu se poate estima cât de solubil este în diferiți solvenți.
Cu toate acestea, ar fi de așteptat să fie extrem de solubil în apă, deoarece dizolvarea acestuia ar elibera cantități enorme de NH3. Teoretic, ar fi o modalitate uimitoare de stocare și transport al amoniacului.
În alți solvenți capabili să accepte legături de hidrogen, cum ar fi alcoolii și aminele, s-ar putea aștepta ca acesta să fie, de asemenea, foarte solubil în aceștia. Aici cationul NH4+ este un donator de legături de hidrogen și OH- acționează ca amândouă.
Exemple ale acestor interacțiuni cu metanolul ar fi: H3N+-H - OHCH3 și HO- - HOCH3 (OHCH3 indică faptul că oxigenul primește legătura de hidrogen, nu că gruparea metil este legată de H).
Riscuri
-În contact cu ochii provoacă iritații care pot duce la afectarea ochilor..
-Este coroziv. Prin urmare, la contactul cu pielea poate provoca iritații și la concentrații mari de reactiv, provoacă arsuri ale pielii. Contactul repetat al hidroxidului de amoniu cu pielea poate face ca acesta să fie uscat, mâncărime și roșie (dermatită)..
-Inhalarea de ceață de hidroxid de amoniu poate provoca iritații acute ale căilor respiratorii, caracterizate prin sufocare, tuse sau dificultăți de respirație. Expunerea prelungită sau repetată la substanță poate duce la infecții bronșice recurente. De asemenea, inhalarea hidroxidului de amoniu poate provoca iritarea plămânilor..
-Expunerea la concentrații mari de hidroxid de amoniu ar putea constitui o urgență medicală, deoarece poate apărea acumularea de lichid în plămâni (edem pulmonar)..
-Concentrația de 25 ppm a fost luată ca limită de expunere, într-o tură de lucru de 8 ore, într-un mediu în care lucrătorul este expus acțiunii nocive a hidroxidului de amoniu.
Reactivitate
-În plus față de potențialul rău pentru sănătate cauzat de expunerea la hidroxid de amoniu, există și alte precauții care trebuie luate în considerare atunci când se lucrează cu substanța..
-Hidroxidul de amoniu poate reacționa cu multe metale, cum ar fi: argint, cupru, plumb și zinc. De asemenea, reacționează cu sărurile acestor metale pentru a forma compuși explozivi și a elibera hidrogen gazos; care, la rândul său, este inflamabil și exploziv.
-Poate reacționa violent cu acizi puternici, de exemplu: acid clorhidric, acid sulfuric și acid azotic. De asemenea, reacționează în același mod cu dimetil sulfat și halogeni..
-Reacționează cu baze puternice, cum ar fi hidroxidul de sodiu și hidroxidul de potasiu, producând amoniac gazos. Acest lucru poate fi verificat observând echilibrul în soluție, în care se adaugă ioni OH- deplasează echilibrul la formarea NH3.
-Cuprul și metalele din aluminiu, precum și alte metale zincate, nu ar trebui utilizate la manipularea hidroxidului de amoniu, datorită acțiunii sale corozive asupra acestora..
Aplicații
În mâncare
-Este utilizat ca aditiv în multe alimente în care acționează ca agent de dospire, control al pH-ului și agent de finisare pentru suprafața alimentelor..
-Lista alimentelor în care este utilizat hidroxidul de amoniu este extinsă și include produse de patiserie, brânzeturi, bomboane de ciocolată, bomboane și budinci..
-Hidroxidul de amoniu este listat ca o substanță sigură de către FDA pentru procesarea alimentelor, atâta timp cât sunt respectate standardele stabilite..
-În produsele din carne este utilizat ca agent antimicrobian, fiind capabil să elimine bacteriile precum E. coli, reducându-l la niveluri nedetectabile. Bacteriile se găsesc în intestinele bovinelor, adaptându-se la mediul acid. Hidroxidul de amoniu, prin reglarea pH-ului, împiedică creșterea bacteriană.
Terapeutică
-Hidroxidul de amoniu are mai multe utilizări terapeutice, inclusiv:
-Soluția de 10% este utilizată ca stimulent al reflexului respirator
-Extern se folosește pe piele pentru a trata mușcăturile și mușcăturile de insecte -Acționează în sistemul digestiv ca antiacid și carminativ, adică ajută la eliminarea gazelor.
În plus, este utilizat ca un subfuz de actualitate pentru durerile musculo-scheletice acute și cronice. Ca o consecință a acțiunii rubeficiente a hidroxidului de amoniu, există o creștere locală a fluxului sanguin, roșeață și iritare..
Industrial și Diverse
-Acționează pentru reducerea NOx (gaze foarte reactive, cum ar fi oxidul azotic (NO) și dioxidul de azot (NO.)Două)) pentru emisiile bateriei și reducerea emisiilor de NOx în emisiile din stivă.
-Este folosit ca plastifiant; aditiv de vopsea și pentru tratarea suprafeței.
-Crește porozitatea părului permițând pigmenților vopselei să aibă o penetrare mai mare, ceea ce obține un finisaj mai bun.
-Hidroxidul de amoniu este utilizat ca agent antimicrobian în tratarea apelor uzate. În plus, este implicat în sinteza cloraminei. Această substanță îndeplinește o funcție similară cu clorul în purificarea apei de la piscină, având avantajul de a fi mai puțin toxică.
-Este utilizat ca inhibitor de coroziune în procesul de rafinare a petrolului.
-Este utilizat ca agent de curățare în diverse produse industriale și comerciale, fiind utilizat pe diferite suprafețe, inclusiv: oțel inoxidabil, porțelan, sticlă și cuptor.
-În plus, este utilizat în producția de detergenți, săpunuri, produse farmaceutice și cerneluri..
În agricultură
Deși nu este administrat direct ca îngrășământ, hidroxidul de amoniu îndeplinește această funcție. Amoniacul este produs din azot atmosferic prin metoda Haber-Bosch și este transportat refrigerat sub punctul său de fierbere (-33 ° C) la locurile de utilizare.
Amoniacul sub presiune este injectat, ca vapori, în sol unde reacționează imediat cu apa edafică și trece sub formă de amoniu (NH4+), care este reținut în locurile de schimb cationic ale solului. În plus, se produce hidroxid de amoniu. Acești compuși sunt o sursă de azot.
Împreună cu fosforul și potasiul, azotul constituie triada principalilor nutrienți ai plantelor esențiali pentru creșterea lor..
Referințe
- Ganong, W. F. (2002). Fiziologie medicală. Ediția a 19-a. Editorial manual modern.
- A. D. Fortes, J. P. Brodholt, I. G. Wood și L. Vocadlo. (2001). Simulare ab initio a amoniacului monohidrat (NH3∙ HDouăO) și hidroxid de amoniu (NH4OH). Institutul American de Fizică. J. Chem. Phys., Vol. 115, Nr. 15, 15.
- Helmenstine, Anne Marie, dr. (6 februarie 2017). Fapte despre hidroxid de amoniu. Recuperat de pe: thoughtco.com
- Grupul Pochteca. (2015). Hidroxid de amoniu. pochteca.com.mx
- NJ Health. (s.f.). Fișa informativă privind substanțele periculoase: hidroxid de amoniu. [PDF]. Recuperat de la: nj.gov
- Învățător de chimie. (2018). Hidroxid de amoniu. Recuperat de pe: chemistrylearner.com
- PubChem. (2018). Hidroxid de amoniu. Recuperat de la: pubchem.ncbi.nlm.nih.gov



Nimeni nu a comentat acest articol încă.