
Proprietăți, riscuri și utilizări ale hidroxidului de bariu (Ba (OH) 2)
hidroxid de bariu este un compus chimic cu formula Ba (OH)Două(HDouăSAU)X. Este o bază puternică și poate fi sub formă anhidră, monohidrată sau octohidratată. Forma monohidrat, numită și apă de barită, este cea mai comună și utilizată comercial. Structura compușilor anhidri și monohidrați este prezentată în Figura 1.
Hidroxidul de bariu poate fi preparat prin dizolvarea oxidului de bariu (BaO) în apă: BaO + 9HDouăO → Ba (OH)Două8HDouăO. Se cristalizează sub formă de octahidrat, care devine monohidrat atunci când este încălzit în aer. La 100 ° C sub vid, monohidratul va produce BaO și apă.
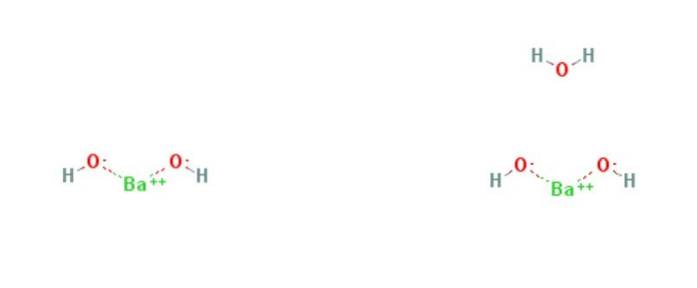
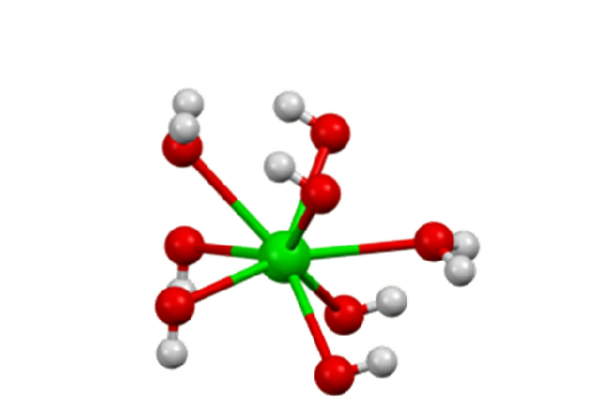
Monohidratul adoptă o structură stratificată (figura 2). Centrele BaDouă+ adoptă o geometrie octaedrică. Fiecare centru BaDouă+ este legat de doi liganzi de apă și șase liganzi de hidroxid, care sunt, respectiv, duble și triple, conectate la centrele BaDouă+ vecini.
În octahidrat, centrele BaDouă+ Indivizii sunt din nou opt coordonate, dar nu împărtășesc liganzi (hidroxid de bariu, S.F.).
Indice articol
- 1 Proprietățile hidroxidului de bariu
- 2 Reactivitate și pericole
- 2.1 Contactul cu ochii
- 2.2 Contactul cu pielea
- 2.3 Inhalare
- 2.4 Ingerare
- 3 utilizări
- 3.1 1- Industrie
- 3.2 2- Laborator
- 3.3 3- Catalizator în reacția Wittig-Horner
- 3.4 4- Alte utilizări
- 4 Referințe
Proprietăți de hidroxid de bariu
Hidroxidul de bariu este cristale octaedrice albe sau transparente. Inodor și cu gust caustic (Centrul Național pentru Informații despre Biotehnologie., 2017). Aspectul său este prezentat în figura 3 (IndiaMART InterMESH Ltd., S.F.).

Forma anhidră are o greutate moleculară de 171,34 g / mol, o densitate de 2,18 g / ml, un punct de topire de 407 ° C și un punct de fierbere de 780 ° C (Royal Society of Chemistry, 2015).
Forma monohidrat are o greutate moleculară de 189,355 g / mol, o densitate de 3,743 g / ml și un punct de topire de 300 ° C (Royal Society of Chemistry, 2015).
Forma octohidrat are o greutate moleculară de 315,46 g / mol, o densitate de 2,18 g / ml și un punct de topire de 78 ° C (Royal Society of Chemistry, 2015).
Compusul este ușor solubil în apă și insolubil în acetonă. Este o bază puternică cu un pKa de 0,15 și 0,64 pentru primul și al doilea OH- respectiv.
Hidroxidul de bariu reacționează similar cu hidroxidul de sodiu (NaOH), dar este mai puțin solubil în apă. Neutralizează acizii exoterm pentru a forma săruri plus apă. Poate reacționa cu aluminiu și zinc pentru a forma oxizi sau hidroxizi metalici și pentru a genera hidrogen gazos.
Poate iniția reacții de polimerizare în compuși organici polimerizabili, în special epoxizi.
Poate genera gaze inflamabile și / sau toxice cu săruri de amoniu, nitruri, compuși organici halogenați, diverse metale, peroxizi și hidroperoxizi. Amestecurile cu gume clorurate explodează atunci când sunt încălzite sau zdrobite (HIDROXID DE BARIU MONOHIDRAT, 2016).
Hidroxidul de bariu se descompune în oxid de bariu atunci când este încălzit la 800 ° C. Reacția cu dioxidul de carbon produce carbonat de bariu. Soluția sa apoasă foarte alcalină suferă reacții de neutralizare cu acizi. Astfel, formează sulfat de bariu și fosfat de bariu cu acizi sulfurici și respectiv fosforici..
HDouăSW4 + Ba (OH)Două Baso4 + 2HDouăSAU
Reacția cu hidrogen sulfurat produce sulfură de bariu. Precipitarea multor săruri de bariu insolubile sau mai puțin solubile poate rezulta dintr-o reacție dublă de înlocuire atunci când o soluție apoasă de hidroxid de bariu este amestecată cu multe soluții de alte săruri metalice..
Amestecarea hidroxidului de bariu solid hidratat cu clorură de amoniu solidă într-un pahar produce o reacție endotermică pentru a produce un lichid, cu evoluția amoniacului. Temperatura scade drastic la aproximativ -20 ° C (Royal Society of Chemistry, 2017).
Ba (OH)Două (s) + 2NH4Cl (s) → BaClDouă (aq) + 2NH3 (g) + HDouăSAU

Ba (OH) 2 reacționează cu dioxidul de carbon pentru a produce carbonat de bariu. Aceasta se exprimă prin următoarea reacție chimică:
Ba (OH) 2 + CO2 → BaCO3 + H2O.
Reactivitate și pericole
Hidroxidul de bariu este clasificat ca un compus stabil, necombustibil, care reacționează rapid și exoterm cu acizii și este incompatibil cu dioxidul de carbon și umezeala. Compusul este toxic și, ca bază puternică, este coroziv.
Inhalarea, ingestia sau contactul cu pielea cu materialul pot provoca leziuni grave sau deces. Contactul cu substanța topită poate provoca arsuri severe la nivelul pielii și ochilor..
Trebuie evitat contactul cu pielea. Efectele contactului sau inhalării pot fi întârziate. Focul poate produce gaze iritante, corozive și / sau toxice. Apele uzate de control al incendiului pot fi corozive și / sau toxice și pot provoca contaminare.
Contact vizual
Dacă compusul intră în contact cu ochii, lentilele de contact trebuie verificate și îndepărtate. Ochii trebuie spălați imediat cu multă apă timp de cel puțin 15 minute, cu apă rece.
Contact cu pielea
În caz de contact cu pielea, zona afectată trebuie clătită imediat timp de cel puțin 15 minute cu multă apă sau un acid slab, de exemplu oțet, în timp ce îndepărtați hainele și încălțămintea contaminate. Acoperiți pielea iritată cu un emolient.
Spălați hainele și încălțămintea înainte de refolosire. Dacă contactul este sever, spălați cu un săpun dezinfectant și acoperiți pielea contaminată cu o cremă antibacteriană..
Inhalare
În caz de inhalare, victima trebuie mutată într-un loc răcoros. Dacă nu respirați, se administrează respirație artificială. Dacă respirația este dificilă, dați oxigen.
Ingerare
Dacă compusul este înghițit, vărsăturile nu trebuie induse. Slăbiți îmbrăcămintea strânsă, cum ar fi gulerul, cămașa sau cravata cămășii.
În toate cazurile, trebuie acordată asistență medicală imediată (Fișa cu date de siguranță a materialului Hidroxid de bariu monohidrat, 2013).
Aplicații
1- Industrie
Industrial, hidroxidul de bariu este utilizat ca un precursor al altor compuși de bariu. Monohidratul este utilizat pentru deshidratarea și îndepărtarea sulfatului din diferite produse. Această aplicație exploatează solubilitatea foarte scăzută a sulfatului de bariu. Această aplicație industrială se aplică și utilizărilor de laborator.
Hidroxidul de bariu este utilizat ca aditiv în termoplastice (cum ar fi rășinile fenolice), zgârieturi și stabilizatori din PVC pentru a îmbunătăți proprietățile plastice. Acest material este utilizat ca aditiv de uz general pentru lubrifianți și grăsimi..
Alte aplicații industriale ale hidroxidului de bariu includ fabricarea zahărului, fabricarea săpunurilor, saponificarea grăsimilor, topirea silicaților și sinteza chimică a altor compuși de bariu și compuși organici (HIDROXID DE BARIU, S.F.).
2- Laborator
Hidroxidul de bariu este utilizat în chimia analitică pentru titrarea acizilor slabi, în special a acizilor organici. Soluția sa apoasă limpede este garantată că nu conține carbonat, spre deosebire de hidroxidul de sodiu și hidroxidul de potasiu, deoarece carbonatul de bariu este insolubil în apă.
Acest lucru permite utilizarea unor indicatori precum fenolftaleina sau timolftaleina (cu modificări de culoare alcaline) fără riscul de erori de titrare cauzate de prezența ionilor de carbonat, care sunt mult mai puțin elementari (Mendham, Denney, Barnes și Thomas, 2000).
Hidroxidul de bariu este folosit ocazional în sinteza organică ca bază puternică, de exemplu pentru hidroliza esterilor și nitrililor:
Hidroxidul de bariu este, de asemenea, utilizat în decarboxilarea aminoacizilor care eliberează carbonat de bariu în acest proces..
De asemenea, este utilizat la prepararea ciclopentanonei, alcoolului diacetonic și a gamma-lactonei D-gulonice.
3- Catalizator în reacția Wittig-Horner
Reacția Wittig-Horner, cunoscută și sub numele de reacția Horner-Wadsworth-Emmons (sau reacția HWE) este o reacție chimică utilizată în chimia organică pentru stabilizarea carbanionilor fosfonat cu aldehide (sau cetone) pentru a produce predominant E-alchene (trans).
Reacția sonochimică Wittig-Horner este catalizată de hidroxid de bariu activat și se realizează în condiții de interfață solid-lichid..
Procesul sonochimic are loc la temperatura camerei și cu o greutate mai mică a catalizatorului și un timp de reacție mai mic decât procesul termic. În aceste condiții, se obțin randamente similare cu cele ale procesului termic..
În lucrarea lui (J. V. Sinisterra, 1987) se analizează influența asupra performanței timpului de sonicare, a greutății catalizatorului și a solventului. Cantități mici de apă trebuie adăugate pentru ca reacția să aibă loc.
Se analizează natura sitului activ al catalizatorului care acționează în proces. Este propus un mecanism ETC pentru procesul sonochimic.
4- Alte utilizări
Hidroxidul de bariu are alte utilizări. Este utilizat în mai multe scopuri, cum ar fi:
- Fabricarea alcalinilor.
- Construcție de sticlă.
- Vulcanizarea cauciucului sintetic.
- Inhibitori de coroziune.
- La fel ca fluidele de foraj, pesticidele și lubrifianții.
- Pentru remedierea cazanului.
- Pentru rafinarea uleiurilor vegetale și animale.
- Pentru pictura în frescă.
- În dedurizarea apei.
- Ca ingredient al remediilor homeopate.
- Pentru curățarea scurgerilor de acid.
- De asemenea, este utilizat în industria zahărului pentru prepararea zahărului din sfeclă.
- Materiale de construcție.
- Produse electrice și electronice.
- Pardoseli.
Referințe
- MONOHIDRAT DE HIDROXID DE BARIU. (2016). Recuperat din cameochemicals: cameochemicals.noaa.gov.
- Hidroxid de bariu. (S.F.). Recuperat de la chemistrylearner: chemistrylearner.com.
- HIDROXID DE BARIU. (S.F.). Recuperat de la chemicalland21: chemicalland21.com.
- IndiaMART InterMESH Ltd… (S.F.). Hidroxid de bariu. Recuperat de la indiamart: dir.indiamart.com.
- V. Sinisterra, A. F. (1987). Ba (OH) 2 ca catalizator în reacțiile organice. 17. Reacția interfațială solid-lichid Wittig-Horner în condiții sonochimice. Jurnalul de chimie organică 52 (17), 3875-3879. researchgate.net.
- Fișă tehnică de securitate a hidroxidului de bariu monohidrat. (2013, 21 mai). Adus de la sciencelab: sciencelab.com/msds.
- Mendham, J., Denney, R. C., Barnes, J. D. și Thomas, M. J. (2000). Analiza chimică cantitativă a lui Vogel (ediția a 6-a). New York: Prentice Hall.
- Centrul Național pentru Informații despre Biotehnologie. (2017, 28 martie). Baza de date compusă PubChem; CID = 16211219. Recuperat de la PubChem: pubchem.ncbi.nlm.nih.gov.
- Societatea Regală de Chimie. (2015). Hidroxid de bariu. Recuperat de la chemspider: chemspider.com.
- Societatea Regală de Chimie. (2015). Hidrat de hidroxid de bariu (1: 2: 1). Recuperat de la chemspider: chemspider.com.
- Societatea Regală de Chimie. (2015). Hidrat de dihidroxibariu (1: 1). Recuperat de la chemspider: chemspider.com.
- Societatea Regală de Chimie. (2017). Reacții endotermice solid-solide. Recuperat de la: learn-chemistry: rsc.org.



Nimeni nu a comentat acest articol încă.