
Structura hipocloritului de potasiu (KOCl), proprietăți
hipoclorit de potasiu Este sarea de potasiu a acidului hipocloros. Este, de asemenea, o sare ternară de potasiu, oxigen și clor și constituie un compus anorganic. Formula sa chimică este KOCl, ceea ce înseamnă că cationul K se găsește în solidul ionic.+ și anionul OCl- într-un raport stoichiometric 1: 1.
Dintre compușii lor omologi (LiOCl, NaOCl, Ca (OCl)Două) este probabil cel mai puțin utilizat și cunoscut în cadrul culturii chimice și pragmatice. Toate aceste săruri au numitorul comun al anionului hipoclorit (OCl-), care le oferă principalele lor caracteristici ca agent de înălbire.
Istoria hipocloritului de potasiu și proprietățile sale fizico-chimice sunt similare cu sarea de hipoclorit de sodiu. A fost produs inițial în 1789 de Claude Louis Berthollet în Javel, Paris. Reacția autorului care a condus la sinteza compusului menționat este exprimată prin următoarea ecuație chimică:
ClDouă + 2KOH => KCl + KClO + HDouăSAU
Conform ecuației, clorul molecular reacționează cu hidroxid de potasiu (sau potasiu caustic), reducând și oxidând atomii de clor. Acest lucru poate fi verificat comparând numărul de oxidare al Cl în KCl (-1) cu cel al Cl în KClO (+1).
Indice articol
- 1 Structura chimică
- 2 Nomenclatură
- 3 Proprietăți
- 3.1 Masa molară
- 3.2 Aspect
- 3.3 Densitatea
- 3.4 Punctul de topire
- 3.5 Punctul de fierbere
- 3.6 Solubilitate în apă
- 3.7 Reactivitate
- 4 utilizări
- 5 Referințe
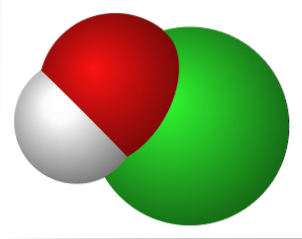
Structura chimică

Imaginea superioară reprezintă interacțiunile electrostatice dintre cationul K+ și anionul OCl- (cu oxigen care are o sarcină formală negativă).
Acești ioni au aceleași proporții stoichiometrice (1: 1) și forțele lor nedirecționale formează un aranjament cristalin, unde K+ este poziționat cât mai aproape de atomul O..
Deși nu există studii care să descrie sistemul de cristal al KOCl (cubic, ortorombic, monoclinic etc.), este suficient să-l vizualizați ca o sferă mare de K+ atras de ionul de geometrie liniară al OCl-.
Se poate crede că, spre deosebire de NaOCl, KOCl formează cristale cu energie de rețea mai mică, deoarece K+ este mai mare decât Na+ comparativ cu OCl-. Această diferență mai mare între razele lor ionice face ca forțele electrostatice prezente între ele să fie mai puțin eficiente..
De asemenea, performanța în soluție apoasă pentru această sare poate fi de așteptat să fie similară cu cea a NaOCl. Înconjurat de apă, K+ -mai voluminoasă - trebuie să aibă o sferă de hidratare mai mare decât cea a Na+. În caz contrar, proprietățile soluțiilor sale (culoare, miros și putere de albire) nu diferă într-un grad semnificativ..
Nomenclatură
De ce se numește astfel sarea hipoclorit de potasiu? Pentru a răspunde la acest lucru, trebuie să recurgeți la nomenclatura sărurilor ternare guvernată de IUPAC. În primul rând, deoarece potasiul are doar valența +1, nu este necesar să-l notăm; prin urmare, este ignorat. Deci, nu scrie hipoclorit de potasiu (I).
Acidul cloric are formula HClO3. Pe măsură ce numărul oxigenilor scade, atomul de clor câștigă mai mulți electroni; adică are numere de oxidare mai puțin pozitive. De exemplu, în acest acid Cl are un număr de oxidare de +5.
Ca și în HClO, Cl are un număr de oxidare de +1 care, în plus, are două unități mai puțini atomi de O (1 în loc de 3 în comparație cu HClO3), sufixul său de nume se schimbă în -oso. La fel, deoarece +1 este cel mai mic număr de oxidare pe care îl poate atinge atomul de Cl, se adaugă prefixul -hipo..
Deci, HClO se numește acid hipocloros. Cu toate acestea, KOCl este sarea sa de potasiu și pentru numerele de oxidare ale Cl mai mici de +5 sufixul -oso este schimbat cu sufixul -ito. În caz contrar, pentru numere de oxidare egale sau mai mari de +5, sufixul este schimbat în -ate. Deci, numele rămâne hipoclorit de potasiu.
Proprietăți
Masă molară
90,55 g / mol.
Aspect
Este un lichid ușor cenușiu.
Densitate
1,16 g / cm3
Punct de topire
-2 ° C (28 ° F; 271 ° K). Acest punct de topire scăzut, în ciuda caracterului ionic al legăturilor sale, demonstrează energia slabă a rețelei cristaline a solidului său pur, produs al sarcinilor monovalente ale K+ și OCl-, și spre deosebire de razele sale ionice.
Punct de fierbere
102 ° C (216 ° F; 375 ° K). Este doar puțin mai mare decât apa pură.
Solubilitatea apei
25% greutate / volum, aceasta fiind o valoare rezonabilă, dată fiind ușurința moleculelor de apă de a solvata ionii K+.
Soluțiile apoase de hipoclorit de potasiu au calități de albire, la fel ca și cele de NaOCl. Este iritant și poate provoca leziuni severe în contact cu pielea, ochii și membranele mucoase. La fel, inhalarea acestuia produce iritație bronșică, suferință respiratorie și edem pulmonar..
Reactivitate
-Hipocloritul de potasiu este un agent oxidant puternic care nu este considerat un element care provoacă incendii sau explozii. Cu toate acestea, este capabil să se combine cu diferite elemente chimice pentru a produce compuși inflamabili și explozivi..
-În contact cu ureea poate forma NCl3, un compus extrem de exploziv. Când este încălzit sau adus în contact cu acizii, produce fum de clorură foarte toxic. Reacționează energic cu cărbune într-o reacție potențial explozivă.
-Se combină cu acetilena pentru a forma cloracetilena explozivă. De asemenea, reacția sa cu materie organică, petrol, hidrocarburi și alcooli poate provoca explozii. Reacția sa cu nitrometan, metanol și etanol poate deveni explozivă.
-Se descompune eliberând oxigen, un proces care poate fi catalizat de rugină sau de recipientul metalic care îl conține..
-Hipocloritul de potasiu trebuie păstrat la rece pentru a evita formarea de clorat de potasiu, a cărui descompunere poate fi chiar explozivă..
Aplicații
-Utilizat ca dezinfectant de suprafață și apă potabilă.
-Degradarea în soluri a hipocloritului de potasiu în clorură de potasiu a sugerat utilizarea acestuia în culturi ca sursă de potasiu, un element nutrițional primar pentru plante..
-Unele companii au sugerat aplicarea acestuia ca înlocuitor al NaOCl ca agent de înălbire, susținând proprietățile benefice ale ionului K+ împotriva impactului asupra mediului cauzat de Na+.
Referințe
- Enviro Tech. Soluția fără sodiu. [PDF]. Adus pe 29 mai 2018, de pe: envirotech.com
- PubChem. (2018). Hipoclorit de potasiu. Adus pe 29 mai 2018, de pe: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Hipoclorit de potasiu. Adus pe 29 mai 2018, de pe: en.wikipedia.org
- Carte chimică. (2017). Hipoclorit de potasiu. Adus pe 29 mai 2018, de pe: chemicalbook.com
- Whitten, Davis, Peck și Stanley. Chimie. (Ed. A VIII-a). CENGAGE Learning, p 873, 874.



Nimeni nu a comentat acest articol încă.