
Caracteristici lizozimice, structură, funcții
lizozime sunt enzime hidrolitice larg distribuite în natură capabile să hidrolizeze legăturile glicozidice ale peptidoglicanului în peretele bacteriilor. Sunt prezente la plante și animale și funcționează ca un mecanism de apărare împotriva infecțiilor bacteriene.
Descoperirea acestor enzime datează din 1922, când Alexander Fleming a realizat că există o proteină care avea capacitatea catalitică de a liza bacteriile în unele țesuturi și secreții umane..
Datorită obținerii sale ușoare și a dimensiunilor reduse, lizozima a fost una dintre primele enzime care au fost secvențiate și a cărei structură a fost determinată prin raze X. În prezent este utilizată ca sistem model în chimie, enzimologie, cristalografie și biologia moleculară a proteinelor..
Lizozima este o enzimă „bacteriolitică” specializată în hidroliza legăturilor glicozidice β-1,4 care se formează între acidul N-acetilmuramic și N-acetilglucozamina prezentă în peretele celular al peptidoglicanului care este expusă în special în bacteriile gram pozitive.
Are diferite funcții, atât digestive, cât și imunologice, în toate organismele în care este exprimat și utilizat ca resursă biotehnologică în diverse scopuri..
Indice articol
- 1 Caracteristici
- 2 Tipuri de lizozime la animale și caracteristicile acestora
- 2.1 Lizozime tip C
- 2.2 Lizozime tip G
- 2.3 Lizozimele de tip I
- 3 Structura
- 4 Funcții
- 5 Referințe
Caracteristici
Lizozimele sunt exprimate de principalele grupuri de organisme vii de pe planetă, dar sunt deosebit de abundente la animale și din acestea au fost purificate și studiate în continuare..
La om, lizozima se găsește în concentrații mari în diferite fluide și țesuturi, cum ar fi ficatul, cartilajul, saliva, mucusul și lacrimile. Se exprimă prin celule hematopoietice și se găsește și în granulocite, monocite și macrofage, precum și în alte celule precursoare ale măduvei osoase..
Lizozimele de origine vegetală hidrolizează substraturi similare cu cele utilizate de alte enzime strâns legate cunoscute sub numele de chitinaze, din acest motiv pot hidroliza legături în chitină, deși cu o eficiență mai mică.
Tipuri de lizozime la animale și caracteristicile acestora
În regnul animal au fost descrise cel puțin trei tipuri de lizozime:
-Lizozime de tip C („C” din „cconvențional "sau"cpui ", Ce înseamnă pui în engleză)
-Lyzozime de tip G („G” din „goose”, Ceea ce înseamnă gâscă în engleză) și
-Lizozime de tip I („I” din „eunevertebrate ”)
Cele trei clase de lizozime diferă unele de altele în ceea ce privește secvențele lor de aminoacizi, caracteristicile lor biochimice și proprietățile lor enzimatice..
Lizozime de tip C
Aceste lizozime sunt considerate enzimele „model” ale acestei familii, deoarece au servit ca model pentru studii de structură și funcție. Sunt cunoscuți sub numele de „C” din limba englezăpui”Întrucât au fost izolați pentru prima dată de albul ouălor de pui.
În această clasă sunt lizozimele produse de majoritatea vertebratelor, în special de păsări și mamifere. De asemenea, include enzime prezente în unele artropode, cum ar fi Lepidoptera, Diptera, unele arahnide și crustacee.
Sunt enzime mici, deoarece au o greutate moleculară care nu depășește 15 kDa. Sunt proteine de bază cu puncte izoelectrice ridicate.
Lizozimele tip G
Prima lizozimă de acest tip a fost identificată în albușul de ouă de gâscă și este prezentă în numeroase specii de păsări, cum ar fi găinile, lebedele, struții, cazuarele și altele..
În unele cazuri, lizozimele de tip G sunt mai abundente decât lizozimele de tip C în albușurile de ouă ale anumitor păsări, în timp ce în altele este opus, lizozimele de tip C sunt mai abundente.
Aceste lizozime sunt prezente și în moluștele bivalve și în unele tunicate. Sunt puțin mai mari decât proteinele de tip C, dar greutatea lor moleculară nu depășește de obicei 25 kDa.
Lizozime de tip I
Aceste lizozime sunt prezente în primul rând la animalele nevertebrate. Prezența sa a fost determinată la anelide, echinoderme, crustacee, insecte, moluște și nematode și este absentă la mamifere și alte vertebrate..
Au puncte izoelectrice mai acide decât cele ale proteinelor de tip C și tip G..
Structura
Cele trei tipuri de enzime animale descrise în secțiunea anterioară au structuri tridimensionale destul de similare..
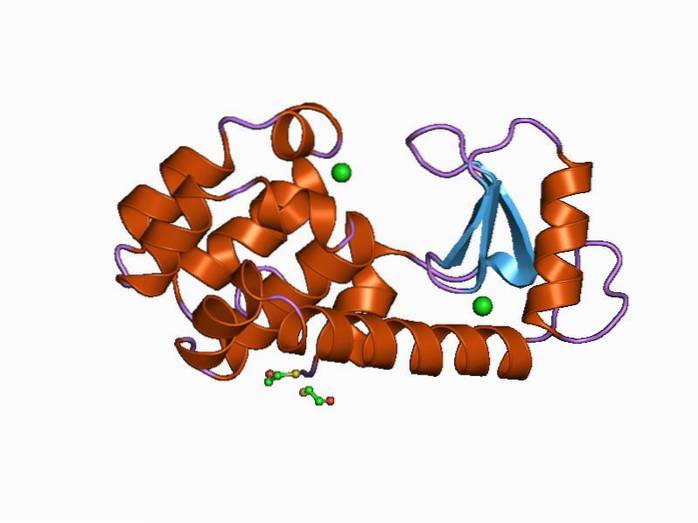
Lizozima umană este o lizozimă de tip C și a fost prima dintre aceste enzime care a fost studiată și caracterizată structural. Este o proteină mică de 130 de reziduuri de aminoacizi și este codificată de o genă localizată pe cromozomul 12, care are 4 exoni și 3 introni..
Structura sa este împărțită în două domenii: unul cunoscut sub numele de domeniul α și altul ca. domeniul β. Domeniul α este compus din patru spirale alfa, iar domeniul β constă dintr-o foaie β antiparalelă și o buclă mare.
Situl catalitic al enzimei este situat în fisura care se formează între ambele domenii și pentru legarea cu substratul are reziduuri de acid glutamic și acid aspartic. În plus, are cel puțin șase „subsite-uri” cunoscute sub numele de A, B, C, D, E și F, capabile să se lege de șase reziduuri consecutive de zahăr.
Caracteristici
Lizozima nu numai că are funcții fiziologice în protecția și lupta împotriva infecțiilor bacteriene din organismele care o exprimă, dar, după cum sa menționat, a fost foarte utilă ca enzimă model din punct de vedere chimic, enzimatic și structural..
În industria de astăzi, este recunoscut ca un bactericid puternic și este utilizat pentru conservarea alimentelor și a medicamentelor.
Datorită reacției pe care aceste enzime o catalizează, ele pot acționa asupra diferitelor populații bacteriene și pot modifica stabilitatea pereților lor, ceea ce se traduce ulterior în liza celulară..
Împreună cu alte enzime similare, lizozimele pot acționa atât asupra bacteriilor gram-pozitive cât și asupra bacteriilor gram-negative, deci pot fi considerate părți ale sistemului „imun” antibacterian al diferitelor clase de organisme.
În celulele albe din sânge prezente în sângele mamiferelor, aceste enzime au funcții importante în degradarea microorganismelor invadatoare, făcându-le esențiale pentru sistemul imunitar al oamenilor și al altor mamifere.
Lizozimele din plante îndeplinesc în esență aceleași funcții ca și la animalele care le exprimă, deoarece acestea sunt prima linie de apărare împotriva agenților patogeni bacterieni..
Referințe
- Callewaert, L. și Michels, W. (2010). Lizozimele din regnul animal. J. Biosci., 35(1), 127-160.
- Merlini, G. și Bellotti, V. (2005). Lizozimă: O moleculă paradigmatică pentru investigarea structurii, funcției și plăcerii greșite a proteinelor. Clinica Chimica Acta, 357, 168-172.
- Mir, A. (1977). Lisozim: o scurtă recenzie. Jurnal medical postuniversitar, 53, 257-259.
- Sahoo, N. R., Kumar, P., Bhusan, B., Bhattacharya, T. K., Dayal, S. și Sahoo, M. (2012). Lizozimă la animale: un ghid de selecție pentru boli. Journal of Animal Science Advances, Două(4), 347-360.
- Wohlkönig, A., Huet, J., Looze, Y. și Wintjens, R. (2010). Relații structurale în superfamilia lizozimatică: dovezi semnificative pentru motivele semnăturii glicozidelor hidrolazei. Plus unu, 5(11), 1-10.



Nimeni nu a comentat acest articol încă.