
Caracteristici ale modelului atomic Schrödinger, postulate

Modelul atomic al lui Schrödinger a fost dezvoltată de Erwin Schrödinger în 1926. Această propunere este cunoscută sub numele de model mecanic cuantic al atomului și descrie comportamentul undelor electronului.

Schrödinger a sugerat că mișcarea electronilor din atom corespunde dualității undă-particulă și, în consecință, electronii se pot mișca în jurul nucleului ca unde staționare..
Schrödinger, care a primit Premiul Nobel în 1933 pentru contribuțiile sale la teoria atomică, a dezvoltat ecuația cu același nume pentru a calcula probabilitatea ca un electron să fie într-o poziție specifică..
Indice articol
- 1 Caracteristicile modelului atomic al lui Schrödinger
- 2 experiment
- 2.1 Experimentul lui Young: prima demonstrație a dualității undă-particulă
- 2.2 Ecuația Schrödinger
- 3 Postulate
- 4 Articole de interes
- 5 Referințe
Caracteristicile modelului atomic al lui Schrödinger
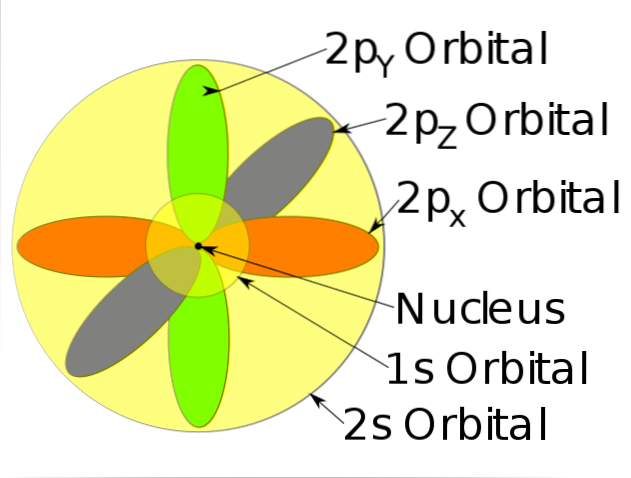
-Descrieți mișcarea electronilor ca unde staționare.
-Electronii se mișcă constant, adică nu au o poziție fixă sau definită în interiorul atomului.
-Acest model nu prezice locația electronului și nici nu descrie calea pe care o ia în interiorul atomului. Doar stabiliți o zonă de probabilitate pentru a localiza electronul.
-Aceste zone de probabilitate sunt numite orbitali atomici. Orbitalii descriu o mișcare de translație în jurul nucleului atomului.
-Acești orbitali atomici au niveluri și subnivele de energie diferite și pot fi definite între nori de electroni.
-Modelul nu are în vedere stabilitatea nucleului, se referă doar la explicarea mecanicii cuantice asociate cu mișcarea electronilor în interiorul atomului..

Experiment
Modelul atomic al lui Schrödinger se bazează pe ipoteza lui Broglie, precum și pe modelele atomice anterioare ale lui Bohr și Sommerfeld.
Broglie a propus că la fel cum undele au proprietăți ale particulelor, particulele au proprietăți ale undelor, având o lungime de undă asociată. Ceva care a generat multă așteptare la momentul respectiv, fiind însuși Albert Einstein susținător al teoriei sale.
Cu toate acestea, teoria de Broglie a avut un neajuns, care a fost că sensul ideii în sine nu a fost bine înțeles: un electron poate fi o undă, dar de ce? Atunci apare figura lui Schrödinger pentru a da un răspuns.
Pentru a face acest lucru, fizicianul austriac s-a bazat pe experimentul lui Young și, pe baza propriilor sale observații, a dezvoltat expresia matematică care îi poartă numele..
Iată fundamentele științifice ale acestui model atomic:
Experimentul lui Young: prima demonstrație a dualității undă-particulă
Ipoteza de Broglie asupra naturii ondulatorii și corpusculare a materiei poate fi demonstrată folosind experimentul lui Young, cunoscut și sub numele de experimentul cu dublă fantă..
Omul de știință englez Thomas Young a pus bazele modelului atomic al lui Schrödinger când în 1801 a efectuat experimentul pentru a verifica natura undelor luminii.
În timpul experimentării sale, Young a împărțit emisia unui fascicul de lumină care trece printr-o mică gaură printr-o cameră de observare. Această împărțire se realizează prin utilizarea unui card de 0,2 milimetri, situat paralel cu fasciculul..
Proiectarea experimentului a fost făcută astfel încât fasciculul de lumină să fie mai larg decât cardul, astfel, la plasarea cardului pe orizontală, fasciculul a fost împărțit în două părți aproximativ egale. Ieșirea fasciculelor de lumină era direcționată de o oglindă.
Ambele fascicule de lumină lovesc un perete într-o cameră întunecată. Acolo a fost evidențiat modelul de interferență dintre cele două unde, care a demonstrat că lumina se poate comporta atât ca o particulă, cât și ca o undă..
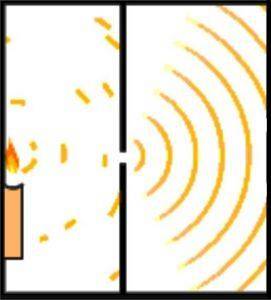
Un secol mai târziu, Albert Einsten a întărit ideea folosind principiile mecanicii cuantice..
Ecuația Schrödinger
Schrödinger a dezvoltat două modele matematice, diferențiind ceea ce se întâmplă în funcție de faptul dacă starea cuantică se schimbă sau nu cu timpul.
Pentru analiza atomică, Schrödinger a publicat la sfârșitul anului 1926 ecuația Schrödinger independentă de timp, care se bazează pe faptul că funcțiile undelor se comportă ca unde staționare..
Aceasta implică faptul că unda nu se mișcă, nodurile sale, adică punctele sale de echilibru, servesc ca pivot pentru restul structurii pentru a se deplasa în jurul lor, descriind o frecvență și o amplitudine specifice..
Schrödinger a definit undele care descriu electronii ca stări staționare sau orbitale și sunt asociate, la rândul lor, cu niveluri diferite de energie.
Ecuația Schrödinger independentă de timp este după cum urmează:
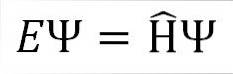
Unde:
ȘI: constanta de proportionalitate.
Ψ: funcția de undă a sistemului cuantic.
Η ̂: Operator hamiltonian.
Ecuația Schrödinger independentă de timp este utilizată atunci când observabilul care reprezintă energia totală a sistemului, cunoscut sub numele de operator hamiltonian, nu depinde de timp. Cu toate acestea, funcția care descrie mișcarea totală a undei va depinde întotdeauna de timp..
Ecuația Schrödinger indică faptul că dacă avem o funcție de undă Ψ, iar operatorul hamiltonian acționează asupra ei, constanta proporționalității E reprezintă energia totală a sistemului cuantic într-una din stările sale staționare.
Aplicat modelului atomic al lui Schrödinger, dacă electronul se mișcă într-un spațiu definit, există valori de energie discrete și dacă electronul se mișcă liber în spațiu, există intervale de energie continue.
Din punct de vedere matematic, există mai multe soluții pentru ecuația Schrödinger, fiecare soluție implică o valoare diferită pentru constanta proporționalității E.
Conform principiului incertitudinii Heisenberg, nu este posibil să se estimeze poziția și energia unui electron. În consecință, oamenii de știință recunosc că estimarea locației electronului în atom este inexactă..
Postulează
Postulatele modelului atomic al lui Schrödinger sunt următoarele:
-Electronii se comportă ca unde staționare care sunt distribuite în spațiu în funcție de funcția de undă Ψ.
-Electronii se mișcă în interiorul atomului pe orbitali. Acestea sunt zone în care probabilitatea de a găsi un electron este considerabil mai mare. Probabilitatea menționată este proporțională cu pătratul funcției de undă ΨDouă.
Configurația electronică a modelului atomic al lui Schrödinguer explică proprietățile periodice ale atomilor și legăturile pe care le formează.
Cu toate acestea, modelul atomic al lui Schrödinger nu ia în considerare rotirea electronilor și nici nu ia în considerare variațiile comportamentului electronilor rapizi datorate efectelor relativiste..
Articole de interes
Modelul atomic de Broglie.
Modelul atomic Chadwick.
Modelul atomic Heisenberg.
Modelul atomic al lui Perrin.
Modelul atomic al lui Thomson.
Model atomic Dalton.
Model atomic Dirac Jordan.
Model atomic al lui Democrit.
Modelul atomic al lui Leucipp.
Modelul atomic Bohr.
Modelul atomic Sommerfeld.
Modelul atomic actual.
Referințe
- Modelul atomic al lui Schrodinger (2015). Recuperat de pe: quimicas.net
- Modelul mecanic cuantic al atomului Recuperat de la: en.khanacademy.org
- Ecuația de undă a lui Schrödinger (s.f.). Universitatea Jaime I. Castellón, Spania. Recuperat de pe: uji.es
- Teoria atomică modernă: modele (2007). © ABCTE. Recuperat de pe: abcte.org
- Modelul atomic al lui Schrodinger (s.f.). Recuperat de la: erwinschrodingerbiography.weebly.com
- Wikipedia, Enciclopedia liberă (2018). Ecuația Schrödinger. Recuperat de pe: es.wikipedia.org
- Wikipedia, The Free Encyclopedia (2017). Experimentul lui Young. Recuperat de pe: es.wikipedia.org



Nimeni nu a comentat acest articol încă.