
Caracteristicile modelului atomic ale lui Thomson, postulatele, particulele subatomice

Modelul atomic al lui Thomson A fost creat de celebrul fizician englez J. J. Thomson, care a descoperit electronul. Pentru această descoperire și munca sa privind conducerea electrică a gazelor, a primit Premiul Nobel pentru fizică din 1906.
Din munca sa cu raze catodice, a devenit clar că atomul nu era o entitate indivizibilă, așa cum postulase Dalton în modelul anterior, ci că conținea o structură internă bine definită..
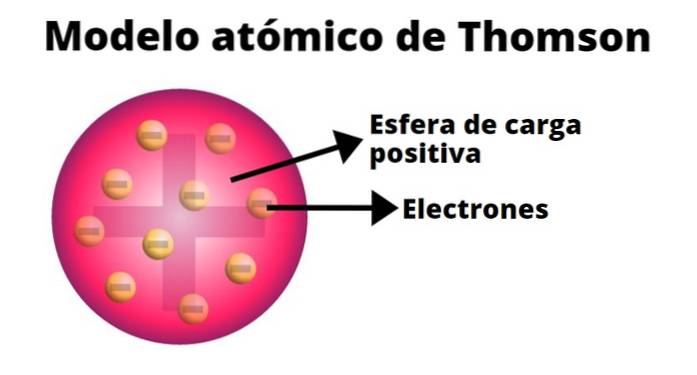
Thomson a realizat un model al atomului pe baza rezultatelor experimentelor sale cu raze catodice. În el a afirmat că atomul neutru din punct de vedere electric era format din sarcini pozitive și negative de aceeași magnitudine..
Indice articol
- 1 Cum s-a numit modelul atomic Thomson și de ce?
- 2 Caracteristici și postulate ale modelului Thomson
- 2.1 Raze catodice
- 3 Particule subatomice din modelul atomic al lui Thomson
- 3.1 Tubul Crookes
- 3.2 Particulele încărcate în câmpuri electrice și magnetice uniforme
- 4 Experimentul Thomson
- 4.1 Relația sarcină-masă a electronului
- 5 Diferențele dintre modelele Thomson și Dalton
- 6 Eșecuri și limitări ale modelului
- 7 Articole de interes
- 8 Referințe
Cum s-a numit modelul atomic Thomson și de ce?
Potrivit lui Thomson, încărcătura pozitivă a fost distribuită în tot atomul și sarcinile negative au fost încorporate în ea ca stafide într-o budincă. Din această comparație a apărut termenul „budincă de stafide”, deoarece modelul era cunoscut informal..

Deși ideea lui Thomson arată astăzi destul de primitivă, pentru vremea sa a reprezentat o contribuție nouă. În scurta viață a modelului (din 1904 până în 1910), a avut sprijinul multor oameni de știință, deși mulți alții au considerat-o erezie.
În cele din urmă, în 1910 au apărut noi dovezi despre structura atomică, iar modelul lui Thomson a căzut rapid în lateral. Acest lucru s-a întâmplat imediat ce Rutherford a publicat rezultatele experimentelor sale de împrăștiere, care au dezvăluit existența nucleului atomic..
Cu toate acestea, modelul lui Thomson a fost primul care a postulat existența particulelor subatomice și rezultatele sale au fost rodul experimentării fine și riguroase. În acest fel, el a stabilit precedentul pentru toate descoperirile care au urmat..
Caracteristici și postulate ale modelului Thomson
Thomson a ajuns la modelul său atomic pe baza mai multor observații. Primul a fost că razele X descoperite recent de Roentgen erau capabile să ionizeze moleculele de aer. Până atunci, singura modalitate de ionizare a fost separarea chimică a ionilor într-o soluție..
Dar fizicianul englez a reușit să ionizeze cu succes chiar și gazele monatomice, cum ar fi heliul, folosind raze X. Acest lucru l-a făcut să creadă că sarcina din interiorul atomului ar putea fi separată și că, prin urmare, nu era indivizibilă. să fie deviat de câmpuri electrice și magnetice.

Deci, Thomson a conceput un model care explica corect faptul că atomul este neutru electric și că razele catodice sunt compuse din particule încărcate negativ..
Folosind dovezi experimentale, Thomson a caracterizat atomul după cum urmează:
-Atomul este o sferă solidă neutră electric, cu o rază de aproximativ 10-10 m.
-Sarcina pozitivă este distribuită mai mult sau mai puțin uniform pe sferă.
-Atomul conține „corpusculi” încărcați negativ, care îi asigură neutralitatea..
-Aceste corpusculi sunt la fel pentru toată materia.
-Când atomul este în echilibru, există n corpusculi dispuși regulat în inele în sfera sarcinii pozitive.
-Masa atomului este distribuită uniform.
Razele catodice

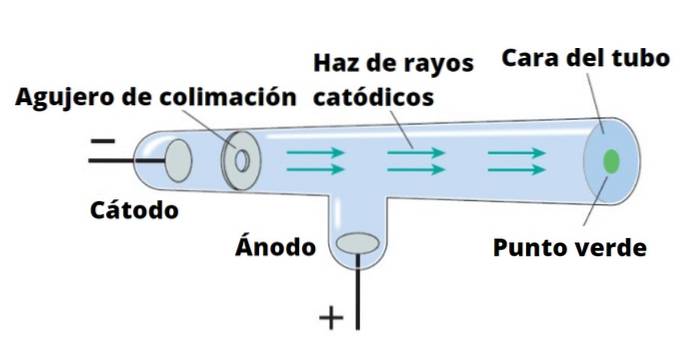
Thomson și-a efectuat experimentele folosind raze catodice, descoperite în 1859. Razele catodice sunt mănunchiuri de particule încărcate negativ. Pentru a le produce, se folosesc tuburi de sticlă sub vid, în care sunt așezați doi electrozi, numiți catod Da anod.
Se trece apoi un curent electric care încălzește catodul, care în acest fel emite radiații invizibile care sunt direcționate direct către electrodul opus..
Pentru a detecta radiațiile, care nu sunt altceva decât razele catodice, peretele tubului din spatele anodului este acoperit cu un material fluorescent. Când radiația ajunge acolo, peretele tubului emite o luminozitate intensă.
Dacă un obiect solid intră în calea razelor catodice, aruncă o umbră pe peretele tubului. Acest lucru indică faptul că razele se deplasează în linie dreaptă și, de asemenea, că pot fi ușor blocate..
Natura razelor catodice a fost larg discutată, deoarece natura lor era necunoscută. Unii au crezut că sunt unde de tip electromagnetic, în timp ce alții au susținut că sunt particule..
Particulele subatomice ale Modelul atomic al lui Thomson
Modelul atomic al lui Thomson este, după cum am spus, primul care postulează existența particulelor subatomice. Corpusculii lui Thomson nu sunt altceva decât electroni, particulele fundamentale ale atomului încărcate negativ..
În prezent știm că celelalte două particule fundamentale sunt protonul încărcat pozitiv și neutronul neîncărcat..
Dar acestea nu au fost descoperite în momentul în care Thomson și-a dezvoltat modelul. Încărcarea pozitivă din atom a fost distribuită în el, nu a luat în considerare nicio particulă care să poarte această sarcină și în acest moment nu au existat dovezi ale existenței sale.
Din acest motiv, modelul său a avut o existență trecătoare, întrucât, în decursul câtorva ani, experimentele de împrăștiere ale lui Rutherford au deschis calea descoperirii protonului. Și în ceea ce privește neutronul, Rutherford însuși și-a propus existența cu câțiva ani înainte ca acesta să fie în cele din urmă descoperit..
Tubul Crookes
Sir William Crookes (1832-1919) a proiectat tubul care îi poartă numele în jurul anului 1870, cu intenția de a studia cu atenție natura razelor catodice. El a adăugat câmpuri electrice și câmpuri magnetice și a observat că razele erau deviate de acestea.
Astfel, Crookes și alți cercetători, inclusiv Thomson, au descoperit că:
- În interiorul tubului catodic a fost generat un curent electric
- Razele au fost deviate de prezența câmpurilor magnetice, la fel ca particulele încărcate negativ..
- Orice metal folosit pentru fabricarea catodului a servit la fel de bine pentru a produce raze catodice, iar comportamentul lor a fost independent de material..
Aceste observații au alimentat discuția despre originea razelor catodice. Cei care au susținut că sunt unde, s-au bazat pe faptul că razele catodice ar putea călători în linie dreaptă. În plus, această ipoteză a explicat foarte bine umbra pe care un obiect solid interpus a aruncat-o pe peretele tubului și, în anumite circumstanțe, se știa că undele ar putea provoca fluorescență.
Dar, pe de altă parte, nu s-a înțeles cum era posibil ca câmpurile magnetice să devieze razele catodice. Acest lucru ar putea fi explicat doar dacă respectivele raze ar fi considerate particule, o ipoteză pe care Thomson a împărtășit-o..
Particule încărcate în câmpuri electrice și magnetice uniforme
O particulă încărcată cu sarcină q, experimentează o forță Fe în mijlocul unui câmp electric uniform E, de magnitudine:
Fe = qE
Când o particulă încărcată traversează perpendicular un câmp electric uniform, cum ar fi cel produs între două plăci cu sarcini opuse, se confruntă cu o deviere și, în consecință, cu o accelerație:
qE = ma
a = qE / m
Pe de altă parte, dacă particula încărcată se mișcă cu o viteză de magnitudine v, în mijlocul unui câmp magnetic uniform de magnitudine B, forța magnetică Fm pe care o experimentează are următoarea intensitate:
Fm = qvB
Atâta timp cât vectorii vitezei și câmpului magnetic sunt perpendiculari. Când o particulă încărcată lovește perpendicular pe un câmp magnetic omogen, ea suferă și o deformare și mișcarea sa este circulară uniformă.
Accelerația centripetă lac în acest caz este:
qvB = mac
La rândul său, accelerația centripetă este legată de viteza particulei v și raza R a căii circulare:
lac = vDouă/ R
Prin urmare:
qvB = mvDouă/ R
Raza traseului circular ar putea fi calculată după cum urmează:
R = mv / qB
Aceste ecuații vor fi folosite mai târziu pentru a recrea modul în care Thomson a derivat relația sarcină-masă a electronului..
Experimentul lui Thomson
Thomson a trecut un fascicul de raze catodice, un fascicul de electroni, deși nu știa încă, prin câmpuri electrice uniforme. Aceste câmpuri sunt create între două plăci conductoare încărcate separate de o distanță mică.
De asemenea, el a trecut razele catodice printr-un câmp magnetic uniform, observând efectul pe care acesta l-a avut asupra fasciculului. Într-un câmp, precum și în celălalt, a existat o deviere a razelor, ceea ce l-a determinat pe Thomson să creadă, corect, că fasciculul era compus din particule încărcate.
Pentru a verifica acest lucru, Thomson a realizat mai multe strategii cu raze catodice:
- El a variat câmpurile electrice și magnetice până când forțele au fost anulate. În acest fel, razele catodice au trecut fără să se confrunte cu devierea. Prin echivalarea forțelor electrice și magnetice, Thomson a fost capabil să determine viteza particulelor din fascicul.
- A anulat intensitatea câmpului electric, în acest fel particulele au urmat o cale circulară în mijlocul câmpului magnetic.
- El a combinat rezultatele etapelor 1 și 2 pentru a determina relația sarcină-masă a „corpusculilor”..
Raportul sarcină-masă al electronului
Thomson a stabilit că raportul sarcină-masă al particulelor care alcătuiau fasciculul de raze catodice are următoarea valoare:
q / m = 1,758820 x 10 11 C.kg-1.
Unde q reprezintă sarcina „corpusculului”, care este de fapt electronul și m este masa acestuia. Thomson a urmat procedura descrisă în secțiunea anterioară, pe care o recreăm aici pas cu pas, cu ecuațiile pe care le-a folosit.

Pasul 1
Egalizați forța electrică și forța magnetică, trecând fasciculul prin câmpurile electrice și magnetice perpendiculare:
qvB = qE
Pasul 2
Determinați viteza dobândită de particulele din fascicul atunci când acestea trec direct fără deviere:
v = E / B
Pasul 3
Anulați câmpul electric, lăsând doar câmpul magnetic (acum există deviere):
R = mv / qB
Cu v = E / B rezultă:
R = mE / qBDouă
Raza orbitei poate fi măsurată, prin urmare:
q / m = v / RB
Ei bine:
q / m = E / RBDouă
Pasii urmatori
Următorul lucru pe care l-a făcut Thomson a fost să măsoare raportul q / m folosind catoduri realizate din diferite materiale. După cum sa menționat anterior, toate metalele emit raze catodice cu caracteristici identice..
Apoi Thomson și-a comparat valorile cu cele ale raportului q / m al ionului hidrogen, obținut prin electroliză și a cărui valoare este de aproximativ 1 x 108 C / kg. Raportul sarcină-masă al electronului este de aproximativ 1750 de ori mai mare decât cel al ionului hidrogen.
Prin urmare, razele catodice au avut o sarcină mult mai mare sau poate o masă mult mai mică decât cea a ionului hidrogen. Ionul hidrogen este pur și simplu un proton, a cărui existență a devenit cunoscută cu mult timp după experimentele de împrăștiere ale lui Rutherford..
Astăzi se știe că protonul este de aproape 1800 de ori mai masiv decât electronul și are o sarcină de aceeași magnitudine și semn opus cu cea a electronului..
Un alt detaliu important este că experimentele lui Thomson nu au determinat în mod direct sarcina electrică a electronului și nici valoarea masei sale separat. Aceste valori au fost determinate de experimentele lui Millikan, care au început în 1906..
Diferențele modelului Thomson și Dalton
Diferența fundamentală a acestor două modele este că Dalton credea că atomul este o sferă. Spre deosebire de Thomson, el nu a propus existența unor sarcini pozitive sau negative. Pentru Dalton, un atom arăta astfel:

După cum am văzut anterior, Thomson a crezut că atomul este divizibil și a cărui structură este formată dintr-o sferă pozitivă și electroni din jurul.
Defectele și limitările modelului
La acea vreme, modelul atomic al lui Thomson a reușit să explice foarte bine comportamentul chimic al substanțelor. De asemenea, el a explicat corect fenomenele care au avut loc în tubul catodic.
Dar, de fapt, Thomson nici măcar nu a numit particulele sale „electroni”, deși termenul fusese deja inventat anterior de George Johnstone Stoney. Thomson pur și simplu le-a numit „corpusculi”..
Deși Thomson a folosit toate cunoștințele de care dispunea în acel moment, există câteva limitări importante în modelul său, care au devenit evidente foarte devreme:
-Sarcina pozitivă nu este distribuită pe tot atomul. Experimentele de împrăștiere Rutherford au arătat că sarcina pozitivă a atomului este în mod necesar limitată la o mică regiune a atomului, care ulterior a devenit cunoscută sub numele de nucleu atomic..
-Electronii au o distribuție specifică în interiorul fiecărui atom. Electronii nu sunt distribuiți în mod egal, ca stafidele din celebra budincă, dar au un aranjament în orbitali pe care modelele ulterioare l-au dezvăluit.
Tocmai aranjarea electronilor din interiorul atomului permite elementelor să fie organizate după caracteristicile și proprietățile lor în tabelul periodic. Aceasta a fost o limitare importantă a modelului Thomson, care nu a putut explica modul în care a fost posibil să se ordoneze elementele în acest fel..
-Nucleul atomic este cel care conține cea mai mare parte a masei. Modelul lui Thomson a postulat că masa atomului era distribuită uniform în interiorul acestuia. Dar astăzi știm că masa atomului este practic concentrată în protoni și neutroni ai nucleului..
De asemenea, este important să rețineți că acest model al atomului nu a permis deducerea tipului de mișcare pe care electronii l-au avut în interiorul atomului..
Articole de interes
Modelul atomic al lui Schrödinger.
Modelul atomic de Broglie.
Modelul atomic Chadwick.
Modelul atomic Heisenberg.
Modelul atomic al lui Perrin.
Model atomic Dalton.
Model atomic Dirac Jordan.
Model atomic al lui Democrit.
Modelul atomic al lui Leucipp.
Modelul atomic Bohr.
Modelul atomic Sommerfeld.
Modelul atomic actual.
Referințe
- Andriessen, M. 2001. Curs HSC. Fizică 2. Jacaranda HSC Science.
- Arfken, G. 1984. Fizică universitară. Academic Press.
- Knight, R. 2017. Fizica pentru oamenii de știință și inginerie: o abordare strategică. Pearson.
- Rex, A. 2011. Fundamentele fizicii. Pearson.
- Wikipedia. Modelul atomic al lui Thomson. Recuperat de pe: es.wikipedia.org.



Nimeni nu a comentat acest articol încă.