
Etape, exemple, exerciții ale metodei de echilibrare Redox
metoda de echilibrare redox Este cea care permite echilibrarea ecuațiilor chimice ale reacțiilor redox, care altfel ar fi o durere de cap. Aici una sau mai multe specii schimbă electroni; cea care le donează sau le pierde se numește specie oxidantă, în timp ce cea care le acceptă sau le câștigă, specia reducătoare.
În această metodă este esențial să se cunoască numărul de oxidare al acestor specii, deoarece acestea dezvăluie câți electroni au câștigat sau pierdut pe mol. Datorită acestui fapt, este posibil să se echilibreze sarcinile electrice prin scrierea electronilor în ecuații ca și cum ar fi reactanți sau produse..
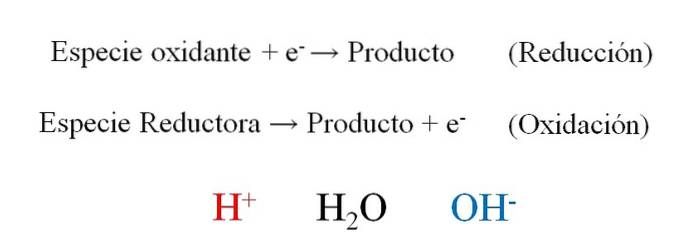
Imaginea de mai sus arată cât de eficient sunt electronii și- acestea sunt plasate ca reactanți atunci când specia oxidantă le câștigă; și ca produse atunci când specia reducătoare le pierde. Rețineți că pentru a echilibra aceste tipuri de ecuații este necesar să se stăpânească conceptele de oxidare și numere de oxidare-reducere..
Specia H+, HDouăO și OH-, În funcție de pH-ul mediului de reacție, acesta permite echilibrarea redox, motiv pentru care este foarte obișnuit să le găsești în exerciții. Dacă mediul este acid, ne întoarcem la H+; dar dacă dimpotrivă mediul este de bază, atunci vom folosi OH- pentru legănare.
Natura reacției în sine dictează care ar trebui să fie pH-ul mediului. De aceea, deși poate fi echilibrat presupunând un mediu acid sau bazic, ecuația finală echilibrată va indica dacă ionii H sunt cu adevărat dispensabili sau nu.+ și OH-.
Indice articol
- 1 Pași
- 1.1 - Generalități
- 1.2 - Echilibrarea într-un mediu acid
- 1.3 - Echilibrarea în mediu de bază
- 2 Exemple
- 3 Exerciții
- 3.1 Exercițiul 1
- 3.2 Exercițiul 2
- 4 Referințe
Pași
- General
Verificați numărul de oxidare al reactanților și al produselor
Să presupunem următoarea ecuație chimică:
Cu (s) + AgNO3(ac) → Cu (NO3)Două + Ag (e)
Aceasta corespunde unei reacții redox, în care apare o modificare a numărului de oxidare a reactanților:
Cu0(s) + Ag+NU3(ac) → CuDouă+(NU3)Două + Ag (e)0
Identificați speciile oxidante și reducătoare
Specia oxidantă câștigă electroni prin oxidarea speciei reducătoare. Prin urmare, numărul său de oxidare scade: devine mai puțin pozitiv. Între timp, numărul de oxidare al speciilor reducătoare crește, deoarece pierde electroni: devine mai pozitiv..
Astfel, în reacția anterioară, cuprul este oxidat, deoarece trece din Cu0 la CuDouă+; iar argintul este redus, pe măsură ce trece de la Ag+ la Ag0. Cuprul este specia reducătoare, iar argintul specia oxidantă.
Scrieți reacțiile pe jumătate și echilibrați atomii și sarcinile
Identificând speciile care câștigă sau pierd electroni, semioreacțiile redox sunt scrise atât pentru reacțiile de reducere, cât și pentru cele de oxidare:
Cu0 → CuDouă+
Ag+ → Ag0
Cuprul pierde doi electroni, în timp ce argintul câștigă unul. Plasăm electronii în ambele jumătăți de reacții:
Cu0 → CuDouă+ + 2e-
Ag+ + și- → Ag0
Rețineți că încărcăturile rămân echilibrate în ambele jumătăți de reacție; dar dacă s-ar adăuga împreună, legea conservării materiei ar fi încălcată: numărul de electroni trebuie să fie egal în cele două jumătăți de reacții. Prin urmare, a doua ecuație se înmulțește cu 2 și se adaugă cele două ecuații:
(Cu0 → CuDouă+ + 2e-) x 1
(Ag+ + și- → Ag0) x 2
Cu0 + 2Ag+ + 2e- → CuDouă+ + 2Ag0 + 2e-
Electronii se anulează deoarece sunt pe părțile laterale ale reactanților și produselor:
Cu0 + 2Ag+ → CuDouă+ + 2Ag0
Aceasta este ecuația ionică globală.
Înlocuiți coeficienții din ecuația ionică în ecuația generală
În cele din urmă, coeficienții stoichiometrici din ecuația anterioară sunt transferați la prima ecuație:
Cu (s) + 2AgNO3(ac) → Cu (NO3)Două + 2Ag (s)
Rețineți că 2 a fost poziționat cu AgNO3 pentru că în această sare argintul este ca Ag+, și același lucru se întâmplă cu Cu (NO3)Două. Dacă această ecuație nu este echilibrată la sfârșit, vom proceda la efectuarea încercării.
Ecuația propusă în pașii anteriori ar fi putut fi echilibrată direct prin încercări și erori. Cu toate acestea, există reacții redox care necesită un mediu acid (H+) sau de bază (OH-) a avea loc. Când se întâmplă acest lucru, nu poate fi echilibrat presupunând că mediul este neutru; după cum s-a arătat (nu H+ și nici OH-).
Pe de altă parte, este convenabil să știm că atomii, ionii sau compușii (în mare parte oxizi) în care apar modificările numerelor de oxidare sunt scrise în jumătățile de reacție. Acest lucru va fi evidențiat în secțiunea de exerciții.
- Echilibrează în mediu acid
Când mediul este acid, este necesar să se oprească la cele două jumătăți de reacții. De această dată, când echilibrăm, ignorăm atomii de oxigen și hidrogen, precum și electronii. Electronii se vor echilibra în cele din urmă.
Apoi, pe partea reacției cu mai puțini atomi de oxigen, adăugăm molecule de apă pentru a compensa aceasta. Pe de altă parte, echilibrăm hidrogenii cu ioni H+. Și, în cele din urmă, adăugăm electronii și continuăm urmând pașii generali deja descriși..
- Echilibru în mediu de bază
Când mediul este bazic, se procedează în același mod ca în mediul acid cu o mică diferență: de data aceasta pe partea în care există mai mult oxigen, va fi localizat un număr de molecule de apă egal cu acest exces de oxigen; iar pe de altă parte, ionii OH- pentru a compensa hidrogenii.
În cele din urmă, electronii sunt echilibrați, se adaugă cele două jumătăți de reacții și coeficienții ecuației ionice globale sunt înlocuiți în ecuația generală.
Exemple
Următoarele ecuații redox echilibrate și neechilibrate servesc ca exemple pentru a vedea cât de mult se schimbă după aplicarea acestei metode de echilibrare:
P4 + ClO- → PO43- + Cl- (dezechilibrat)
P4 + 10 ClO- + 6 oreDouăO → 4 PO43- + 10 Cl- + 12 h+ (mediu acid echilibrat)
P4 + 10 ClO- + 12 OH- → 4 PO43- + 10 Cl- + 6 oreDouăO (mediu echilibrat de bază)
EuDouă + KNO3 → Eu- + KIO3 + NU3- (dezechilibrat)
3IDouă + KNO3 + 3HDouăO → 5I- + KIO3 + NU3- + 6H+ (mediu acid echilibrat)
CrDouăSAUDouă7- + HNODouă → Cr3+ + NU3- (dezechilibrat)
3HNODouă + 5H+ + CrDouăSAUDouă7- → 3NO3- +2Cr3+ + 4HDouăO (mediu acid echilibrat)
Instruire
Exercitiul 1
Echilibrați următoarea ecuație în mediu de bază:
EuDouă + KNO3 → Eu- + KIO3 + NU3-
Pași generali
Începem prin a scrie numerele de oxidare ale speciilor despre care suspectăm că au fost oxidate sau reduse; în acest caz, atomii de iod:
EuDouă0 + KNO3 → Eu- + KI5+SAU3 + NU3-
Rețineți că iodul este oxidat și în același timp redus, așa că continuăm să scriem cele două jumătăți de reacție respective:
EuDouă → Eu- (reducere, pentru fiecare I- Se consumă 1 electron)
EuDouă → IO3- (oxidare, pentru fiecare IO3- 5 electroni sunt eliberați)
În jumătatea reacției de oxidare plasăm anionul IO3-, și nu atomul de iod ca mine5+. Echilibrăm atomii de iod:
EuDouă → 2I-
EuDouă → 2IO3-
Echilibru în mediu de bază
Acum ne concentrăm pe echilibrarea semi-reacției de oxidare într-un mediu de bază, deoarece are o specie oxigenată. Adăugăm pe partea produsului același număr de molecule de apă ca atomi de oxigen:
EuDouă → 2IO3- + 6HDouăSAU
Și în partea stângă echilibrăm hidrogenii cu OH-:
EuDouă + 12OH- → 2IO3- + 6HDouăSAU
Scriem cele două jumătăți de reacții și adăugăm electronii lipsă pentru a echilibra sarcinile negative:
EuDouă + 2e- → 2I-
EuDouă + 12OH- → 2IO3- + 6HDouăO + 10e-
Egalizăm numerele electronilor în ambele reacții pe jumătate și le adăugăm:
(EuDouă + 2e- → 2I-) x 10
(EuDouă + 12OH- → 2IO3- + 6HDouăO + 10e-) x 2
12IDouă + 24 OH- + 20e- → 20I- + 4IO3- + 12HDouăO + 20e-
Electronii se anulează și împărțim toți coeficienții la patru pentru a simplifica ecuația ionică globală:
(12IDouă + 24 OH- → 20I- + 4IO3- + 12HDouăO) x ¼
3IDouă + 6OH- → 5I- + IO3- + 3HDouăSAU
Și, în cele din urmă, înlocuim coeficienții ecuației ionice în prima ecuație:
3IDouă + 6OH- + KNO3 → 5I- + KIO3 + NU3- + 3HDouăSAU
Ecuația este deja echilibrată. Comparați acest rezultat cu echilibrarea în mediu acid din exemplul 2.
Exercițiul 2
Echilibrați următoarea ecuație într-un mediu acid:
CredinţăDouăSAU3 + CO → Fe + CODouă
Pași generali
Ne uităm la numărul de oxidare a fierului și carbonului pentru a afla care dintre cele două a fost oxidat sau redus:
CredinţăDouă3+SAU3 + CDouă+O → Credință0 + C4+SAUDouă
Fierul a fost redus, făcându-l specia oxidantă. Între timp, carbonul a fost oxidat, comportându-se ca specie reducătoare. Semi-reacțiile de oxidare și reducere în cauză sunt:
CredinţăDouă3+SAU3 → Credință0 (reducere, pentru fiecare Fe se consumă 3 electroni)
CO → CODouă (oxidare, pentru fiecare CODouă Se eliberează 2 electroni)
Rețineți că scriem oxidul, FeDouăSAU3, deoarece conține credință3+, în loc de a plasa doar Fe3+. Echilibrăm atomii necesari, cu excepția celor de oxigen:
CredinţăDouăSAU3 → 2Fe
CO → CODouă
Și continuăm să realizăm echilibrarea într-un mediu acid în ambele jumătăți de reacție, deoarece există specii oxigenate între ele..
Echilibru în mediu acid
Adăugăm apă pentru a echilibra oxigenii, apoi H+ pentru a echilibra hidrogenii:
CredinţăDouăSAU3 → 2Fe + 3HDouăSAU
6H+ + CredinţăDouăSAU3 → 2Fe + 3HDouăSAU
CO + HDouăO → CODouă
CO + HDouăO → CODouă + 2H+
Acum echilibrăm încărcăturile plasând electronii implicați în jumătățile de reacție:
6H+ + 6e- + CredinţăDouăSAU3 → 2Fe + 3HDouăSAU
CO + HDouăO → CODouă + 2H+ + 2e-
Egalizăm numărul de electroni în ambele reacții pe jumătate și le adăugăm:
(6H+ + 6e- + CredinţăDouăSAU3 → 2Fe + 3HDouăO) x 2
(CO + HDouăO → CODouă + 2H+ + 2e-) x 6
12 h+ + 12e- + 2FeDouăSAU3 + 6CO + 6HDouăO → 4Fe + 6HDouăO + 6CODouă + 12H+ + 12e-
Anulăm electronii, ionii H.+ și moleculele de apă:
2FeDouăSAU3 + 6CO → 4Fe + 6CODouă
Dar acești coeficienți pot fi împărțiți la doi pentru a simplifica ecuația și mai mult, având:
CredinţăDouăSAU3 + 3CO → 2Fe + 3CODouă
Se pune această întrebare: a fost necesară echilibrarea redox pentru această ecuație? Prin încercări și erori, ar fi fost mult mai rapid. Aceasta arată că această reacție are loc indiferent de pH-ul mediului..
Referințe
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Helmenstine, Anne Marie, dr. (22 septembrie 2019). Cum se echilibrează reacțiile Redox. Recuperat de pe: thoughtco.com
- Ann Nguyen și Luvleen Brar. (05 iunie 2019). Echilibrarea reacțiilor Redox. Chimie LibreTexte. Recuperat de pe: chem.libretexts.org
- Quimitube. (2012). Exercițiul 19: Ajustarea unei reacții redox în mediu bazic cu două jumătăți de reacție de oxidare. Recuperat de pe: quimitube.com
- Universitatea Washington din St. Louis. (s.f.). Probleme de practică: reacții redox. Recuperat de la: chemistry.wustl.edu
- John Wiley & Sons. (2020). Cum se echilibrează ecuațiile Redox. Recuperat de pe: dummies.com
- Rubén Darío O. G. (2015). Echilibrarea ecuațiilor chimice. Recuperat de la: aprendeenlinea.udea.edu.co



Nimeni nu a comentat acest articol încă.