
Structura, proprietățile și utilizările peroxidului de bariu (BaO2)

peroxid de bariu este un compus ionic și anorganic a cărui formulă chimică este BaODouă. Fiind un compus ionic, este format din ioni BaDouă+ pe mineDouăDouă-; acesta din urmă este ceea ce este cunoscut sub numele de anion peroxid și din această cauză BaODouă își dobândește numele. Acesta fiind cazul, BaODouă este un peroxid anorganic.
Sarcinile ionilor săi dezvăluie modul în care acest compus este format din elemente. Metalul de bariu din grupa 2 dă doi electroni moleculei de oxigen, ODouă, ai căror atomi nu sunt folosiți pentru a se reduce la anioni oxizi, SAUDouă-, dar să fie ținut împreună printr-o simplă legătură, [O-O]Două-.

Peroxidul de bariu este un solid granular la temperatura camerei, de culoare albă, cu ușoare tonuri cenușii (imaginea superioară). Ca aproape toți peroxizii, acesta trebuie manipulat și depozitat cu grijă, deoarece poate accelera oxidarea anumitor substanțe.
Dintre toți peroxizii formați din grupele 2 metale (domnul Becambara), BaODouă este termodinamic cea mai stabilă împotriva descompunerii sale termice. Când este încălzit, eliberează oxigen și se produce oxid de bariu, BaO. BaO poate reacționa cu oxigenul din mediu, la presiuni ridicate, pentru a forma din nou BaODouă.
Indice articol
- 1 Structură
- 1.1 Energia rețelei cristaline
- 1.2 Hidrați
- 2 Pregătirea sau sinteza
- 3 Proprietăți
- 3.1 Aspect fizic
- 3.2 Masa moleculară
- 3.3 Densitatea
- 3.4 Punctul de topire
- 3.5 Punctul de fierbere
- 3.6 Solubilitate în apă
- 3.7 Descompunerea termică
- 4 Nomenclatură
- 5 utilizări
- 5.1 Producător de oxigen
- 5.2 Producător de peroxid de hidrogen
- 6 Referințe
Structura
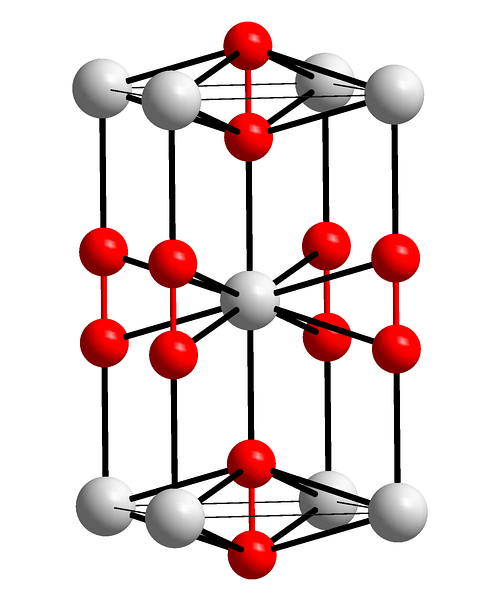
Imaginea superioară arată celula unității tetragonale a peroxidului de bariu. În interior se pot vedea cationii BaDouă+ (sfere albe), iar anionii ODouăDouă- (sfere roșii). Rețineți că sferele roșii sunt unite printr-o singură legătură, deci reprezintă geometria liniară [O-O]Două-.
Din această celulă unitară, pot fi construite cristale BaODouă. Dacă este observat, anionul ODouăDouă- se vede că este înconjurat de șase BaDouă+, obținând un octaedru ale cărui vârfuri sunt albe.
Pe de altă parte, și mai evident, fiecare BaDouă+ este înconjurat de zece ODouăDouă- (sferă albă în centru). Tot cristalul constă din această ordine constantă pe termen scurt și lung.
Energia rețelei de cristal
Dacă se observă și sferele albe roșii, se va observa că acestea nu diferă prea mult în ceea ce privește dimensiunile sau razele ionice. Acest lucru se datorează faptului că cationul BaDouă+ este foarte voluminoasă și interacțiunile sale cu anionul ODouăDouă- stabilizează energia rețelei cristalului într-un grad mai bun în comparație cu modul în care, de exemplu, ar face cationii de Ca.Două+ și MgDouă+.
Acest lucru explică, de asemenea, de ce BaO este cel mai instabil dintre oxizii alcalino-pământoși: ionii Ba.Două+ pe mineDouă- diferă considerabil ca mărime, destabilizându-și cristalele.
Deoarece este mai instabil, tendința BaO este mai micăDouă descompunându-se pentru a forma BaO; contrar peroxizilor SrODouă, CaODouă și MgODouă, ai căror oxizi sunt mai stabili.
Hidratați
BaODouă poate fi găsit sub formă de hidrați, dintre care BaODouă∙ 8HDouăSau este cel mai stabil dintre toate; și, de fapt, acesta este cel comercializat, în locul peroxidului de bariu anhidru. Pentru a obține cea anhidră, BaO trebuie uscat la 350 ° CDouă∙ 8HDouăSau, în scopul eliminării apei.
Structura sa cristalină este, de asemenea, tetragonală, dar cu opt molecule de HDouăO interacționând cu ODouăDouă- prin legături de hidrogen și cu BaDouă+ prin interacțiuni dipol-ion.
Alți hidrați, ale căror structuri nu conțin prea multe informații în acest sens, sunt: BaODouă∙ 10HDouăO, BaODouă∙ 7HDouăO și BaODouă∙ HDouăSAU.
Pregătirea sau sinteza
Prepararea directă a peroxidului de bariu constă în oxidarea oxidului său. Acesta poate fi utilizat din barita minerală sau din sarea de nitrat de bariu, Ba (NO3)Două; ambele sunt încălzite într-o atmosferă îmbogățită cu aer sau oxigen.
O altă metodă constă în reacția Ba (NO3)Două cu peroxid de sodiu:
Baie3)Două + N / ADouăSAUDouă + xHDouăO => BaODouă∙ xHDouăO + 2NaNO3
Apoi hidratul BaODouă∙ xHDouăSau este supus încălzirii, filtrat și terminat prin uscare cu vid.
Proprietăți
Aspectul fizic
Este un solid alb care poate deveni cenușiu dacă are impurități (fie BaO, Ba (OH)Două, sau alte specii chimice). Dacă este încălzit la o temperatură foarte ridicată, va emite flăcări verzui, datorită tranzițiilor electronice ale cationilor Ba.Două+.
Masa moleculara
169,33 g / mol.
Densitate
5,68 g / ml.
Punct de topire
450 ° C.
Punct de fierbere
800 ° C. Această valoare este în concordanță cu ceea ce ar trebui să se aștepte de la un compus ionic; și chiar mai mult, dintre cele mai stabile peroxide alcalino-pământoase. Cu toate acestea, BaO nu fierbe cu adevăratDouă, mai degrabă, oxigenul gazos este eliberat ca urmare a descompunerii sale termice.
Solubilitatea apei
Insolubil. Cu toate acestea, poate fi supus lent hidrolizei pentru a produce peroxid de hidrogen, HDouăSAUDouă; și în plus, solubilitatea sa în mediu apos crește dacă se adaugă un acid diluat.
Descompunerea termică
Următoarea ecuație chimică arată reacția de descompunere termică pe care o suferă BaODouă:
2BaODouă <=> 2BaO + ODouă
Reacția este unidirecțională dacă temperatura este peste 800 ° C. Dacă presiunea crește imediat și temperatura scade, tot BaO va fi transformat înapoi în BaODouă.
Nomenclatură
Un alt mod de a denumi BaODouă este peroxid de bariu, conform nomenclaturii tradiționale; întrucât bariul poate avea doar valența +2 în compușii săi.
În mod greșit, nomenclatura sistematică este utilizată pentru a se numi dioxid de bariu (binoxid), considerându-l un oxid și nu un peroxid.
Aplicații
Producător de oxigen
Folosind barita minerală (BaO), este încălzită cu curenți de aer pentru a elimina conținutul său de oxigen, la o temperatură de aproximativ 700 ° C..
Dacă peroxidul rezultat este încălzit ușor sub vid, oxigenul se regenerează mai repede și barita poate fi refolosită pe termen nelimitat pentru a stoca și produce oxigen..
Acest proces a fost conceput comercial de L. D. Brin, acum învechit.
Producător de peroxid de hidrogen
Peroxidul de bariu reacționează cu acidul sulfuric pentru a produce peroxid de hidrogen:
GrinziDouă + HDouăSW4 => HDouăSAUDouă + Baso4
Prin urmare, este o sursă de HDouăSAUDouă, manipulat în special cu hidratul său BaODouă∙ 8HDouăSAU.
Conform acestor două utilizări menționate, BaODouă permite dezvoltarea lui ODouă si HDouăSAUDouă, atât agenți oxidanți, în sinteza organică, cât și în procesele de albire din industria textilă și a coloranților. Este, de asemenea, un bun agent dezinfectant..
Mai mult, de la BaODouă pot fi sintetizați alți peroxizi, cum ar fi sodiu, NaDouăSAUDouă, și alte săruri de bariu.
Referințe
- S.C. Abrahams, J Kalnajs. (1954). Structura cristalină a peroxidului de bariu. Laborator pentru izolarea cercetării, Institutul de Tehnologie din Massachusetts, Cambridge, Massachusetts, S.U.A..
- Wikipedia. (2018). Peroxid de bariu. Recuperat de pe: en.wikipedia.org
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Atomism. (2012). Peroxid de bariu. Recuperat de pe: barium.atomistry.com
- Khokhar și colab. (2011). Studiul pregătirii la scară de laborator și dezvoltarea unui proces pentru peroxidul de bariu. Recuperat de pe: academia.edu
- PubChem. (2019). Peroxid de bariu. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- PrebChem. (2016). Prepararea peroxidului de bariu. Recuperat de pe: prepchem.com



Nimeni nu a comentat acest articol încă.